О. Гришо, кандидат фармацевтичних наук Л. Камеліна, лікар-дерматовенеролог вищої категорії
1. ВСТУП
Гіалуронові кислоти (ГК, синонім – гіалуронан) – група кислих глікозаміногліканів – високомолекулярних лінійних біополімерів, молекули яких побудовані з чергованих залишків D-глюкуронової кислоти та N-ацетил-D-глюкозаміну, з’єднаних β-(1→4) та β-(1→3)-зв’язками. Широко представлені у тканинах людини та тварин, де є найважливішим компонентом основної речовини сполучної тканини, синовіальної рідини, склоподібного тіла; у великих кількостях виявлені у пупковому канатику, шкірі, оболонках яйцеклітин, а також у рогівці, кістках, клапанах серця [1].
Незважаючи на відносно просту хімічну будову, ГК мають дивовижні властивості. Після відкриття ГК в 1934 припускалося, що ця група речовин впливає на формування біофізичних та гомеостатичних властивостей тканин. Однак подальші дослідження показали, що ГК грають одну з ключових ролей у міжклітинних взаємодіях. Як «цементуючі» компоненти основної речовини сполучної тканини ГК впливають на її проникність, визначають бар’єрну та захисну функції міжклітинного матриксу.
Широкий спектр біологічної активності, відсутність антигенності при високій біосумісності з тканинами та середовищем людського організму, можливість цілеспрямованої модифікації властивостей – всі ці фактори зумовили широке застосування різних препаратів та виробів на основі ГК у медицині та косметології.
2. ВЛАСТИВОСТІ ГІАЛУРОНОВОЇ КИСЛОТИ
З еволюційної точки зору, гіалуронова кислота є старовинною молекулою. Молекулярна маса ГК дуже велика і становить 0,086×106–10×106 Да.
Вони легко зв’язують воду (одна молекула ГК утримує 200-500 молекул води) і утворюють дуже в’язкі розчини, у яких молекули цих кислот можуть формувати замкнуті тривимірні структури. Висока щільність негативних зарядів ГК притягує катіони, такі як Na+, К+, Са2+ та Мg2+, які є осмотично активними та спричиняють надходження великої кількості води в матрикс. ГК зв’язують інтерстиціальну воду в міжклітинних просторах, підвищуючи тим самим опір тканин стисканню (на противагу до колагенових фібрил, які зумовлюють резистентність матриксу до сил розтягування), беруть участь в іонному обміні, транспорті і розподілі води в тканинах. З основами ГК дають солі, з білками вступають у ковалентний зв’язок, втрачаючи при цьому здатність розчинятися у воді при кислих значеннях рН та утворюючи так звані муцинові згустки [1].
Як зазначалося вище, ГК входять до основних компонентів таких природних рідин, як склоподібне тіло людського ока (0,1–0,4 мг/г у вологому стані); синовіальна рідина (3-4 мг/мл); матрикс, утворений скупченням клітин навколо ооциту перед овуляцією (~0,5 мг/мл); патологічний матрикс, який закупорює артерію при коронарному рестенозі. Незважаючи на те, що масова частка ГК у тканині невелика, вона є основним структурним елементом матриксу. Наприклад, присутня у гіалінових хрящах (~1 мг/г у вологому стані) у достатній кількості, щоб заповнити об’єм тканини за відсутності інших компонентів. У меншій мірі ГК присутня в матриксі інших сполучних тканин, наприклад, у тканинах, що оточують клітини гладкої мускулатури в аорті, та у фібробластах у дермі шкіри. Однак, як і в хрящовій тканині, у матриксах цих тканин ГК утворює каркас для зчеплення великих молекул хондроїтинсульфату протеоглікану [2].
ГК (у дуже малій концентрації) взаємодіють з деякими клітинами, виявляючи при цьому високу специфічність і запускаючи важливі реакції у відповідь. Багато клітин мають рецептори до ГК [3].
ГК мають риси, які, на думку доктора Mitchell [4], властиві молекулам-«транспортерам», які переносять хімічні сполуки через мембрани клітин. Синтез ГК відбувається у мезенхімальних тканинах, очевидно, у молодих фібробластах та опасистих клітинах. Проте весь процес біосинтезу ГК, особливо полімеризація, остаточно не з’ясований. Встановлено, що N-ацетилглюкозамін та D-глюкуронова кислота, з яких будуються молекули ГК, утворюються з глюкози, а аміногрупи (NH2-групи) ГК належать глутаміну.
Обмін ГК в організмі відбувається швидко – період біологічного напівжиття їх молекул становить близько двох діб. Регулюється обмін ГК гормонами щитовидної та статевих залоз, кортизолом, адренокортикотропним гормоном тощо. Катаболізуються ГК за допомогою ферментів гіалуронідаз, що каталізують гідроліз та деполімеризацію цих кислот. Гіалуронідази містяться практично у всіх органах і тканинах людини та інших ссавців (особливо багато їх у яєчках, спермі та яєчниках), у тканинах швидко зростаючих пухлин, у плазматичних мембранах патогенних мікроорганізмів.
3. ЗАСТОСУВАННЯ ГІАЛУРОНОВИХ КИСЛОТ У МЕДИЦІНІ
Гіалуронові кислоти є привабливим будівельним матеріалом для створення нових біосумісних і біодеградованих полімерів, які можна застосовувати для доставки ліків до тканин, у біоінженерії тканин, для прискорення загоєння ран, формування постхірургічних рубців, в офтальмології та ортопедії.
ГК служать для контрольованої доставки та вивільнення ліків. Лікарські препарати ковалентно чи нековалентно зв’язуються із гіалуронатами (солями ГК). Гіалуронати створюють депо препарату в місці ін’єкції та, поступово руйнуючись, вивільняють ліки, покращуючи фармакологічний профіль та запобігаючи розвитку можливих побічних реакцій.
ГК застосовують як засіб для будь-якого виду внутрішньосуглобового лікування, а також з метою захисту суглобового хряща від можливого несприятливого впливу застосовного лікарського препарату. Було доведено, що ГК пролонгують ефект лікарських засобів, зменшуючи їхню дифузію з суглобового простору [5].
Ще однією сферою використання ГК стала артропластика, а також остеотомія та всі типи внутрішньосуглобових операцій, де ГК запобігають надмірному фіброзуванню та сприяють нормальному загоєнню тканин.
Наявність дезінфікуючої, ранозагоювальної та регенеруючої дії гіалуронових кислот дозволила створити ефективні препарати для лікування опіків та променевих уражень шкіри. ГК мають виражену біостимулюючу дію при трофічних виразках, що довго не гояться. Підшкірне та місцеве введення ГК запобігає утворенню грануляційних тканин, спайок, рубців, нормалізує кровопостачання.
Останніми роками зростає популярність захисних ранових покриттів, які містять ГК. Переваги використання таких покриттів є очевидними. Поперше, вони легко руйнуються та виводяться з організму; по-друге, ГК імунонейтральні, отже, не здатні спровокувати запальну або алергійну реакцію; по-третє, з ГК досить легко отримати напівпроникні захисні покриття, що забезпечують добрий газообмін у рані. Відомі полімерні покриття, що містять протизапальний агент на додаток до ГК. Такі покриття не тільки ізолюють ранову поверхню, а й мають на неї пролонгований лікувальний вплив [6].
ГК, маючи потужну регенеруючу дію, запобігають утворенню грануляційних тканин, спайок, рубців; нормалізують кровообіг, відновлюють імунні реакції шкіри, нормалізують метаболізм та обмінні процеси у шкірі.
Однією з причин пильної уваги дослідників до ГК є їхня здатність впливати на поведінку клітини. Це пов’язано, по-перше, з ключовою роллю гіалуронових кислот в організації позаклітинного матриксу, а по-друге, з їх властивістю рецепторопосередковано взаємодіяти з клітинами.
В останнє десятиліття ГК стали широко застосовуватись і в естетичній медицині. Матеріали на основі ГК використовують для корекції зморшок (філери) та для відновлення тургору та еластичності шкіри (біоревіталізація). У філерах використовують стабілізовані (або модифіковані) ГК. На сьогоднішній день філери на основі ГК виявилися найбільш фізіологічними та безпечними. У біоревіталізації застосовують немодифіковані ГК з певними параметрами. Процедури зволоження та біоревіталізації з використанням ін’єкцій немодифікованих ГК відносять до найефективніших методів, що відновлюють властивості шкіри фізіологічним шляхом.
Останнім часом з’явився новий клас біоревіталізаторів на основі внутрішнього ефіру ГК. В рамках цієї статті буде здійснено спробу познайомити читача із різними модифікаціями ГК.
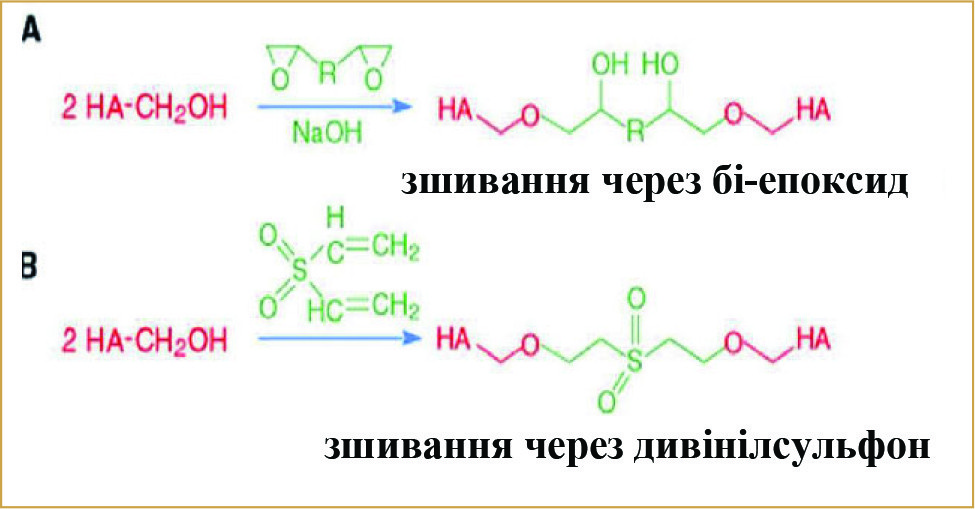
(Рис. 1) Зшивання на основі гідроксильної групи
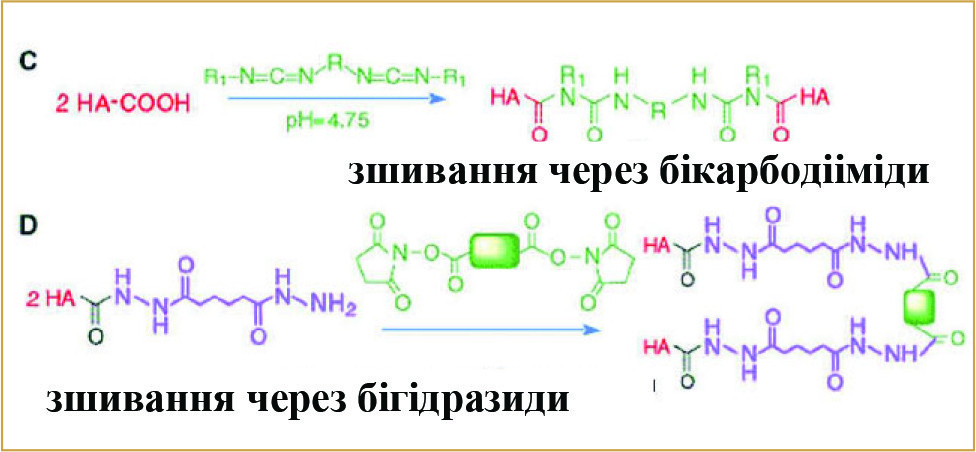
(Рис. 2) Зшивання на основі карбоксильної групи
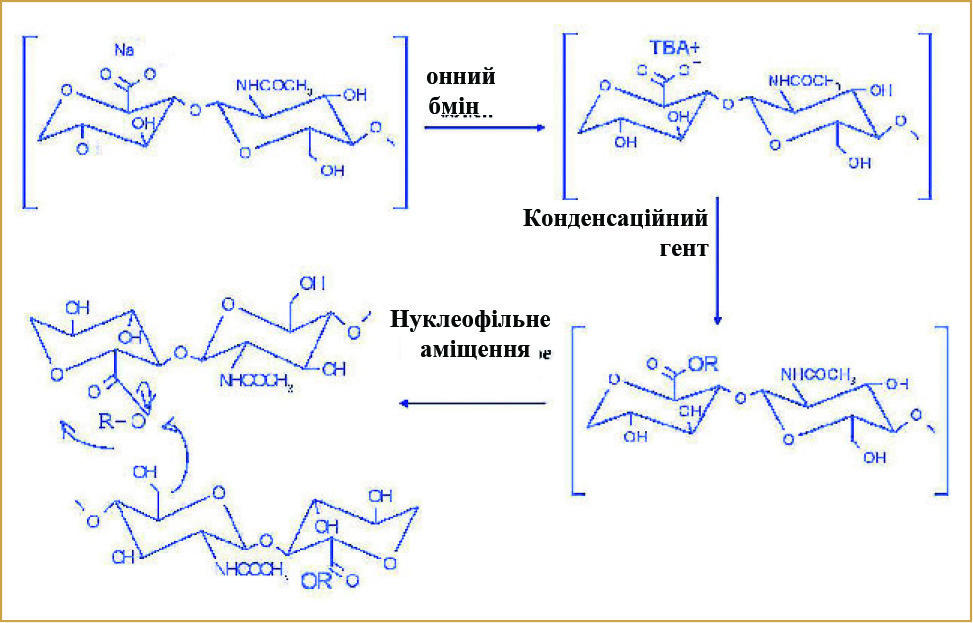
(Рис. 3) Утворення внутрішніх складно-ефірних зв’язків у молекулі АСР
1 стадія – реакція іонного обміну (ТВА – тетрабутиламоній); 2 стадія – утворення проміжної речовини (активного ефіру) при реакції ГК з конденсаційним агентом (CMPJ – хлорметилпіридініодид); 3 стадія – реакція нуклеофільного заміщення, що призводить до зшивання між ланцюжками однієї і тієї ж молекули ГК з утворенням внутрішньомолекулярного ефірного зв’язку
4. ВИДИ ХІМІЧНИХ МОДИФІКАЦІЙ ГІАЛУРОНОВИХ КИСЛОТ
Донедавна завдання створення матеріалу на основі ГК, який залишався б у шкірі тривалий час і при цьому зберігав свою специфічну біологічну активність, залишалося невирішеним. Проблема полягала в тому, що нативні ГК (навіть з дуже високою молекулярною вагою) зазнають порівняно швидкої резорбції.
Створенню нових біоматеріалів перешкоджають слабкі біомеханічні властивості природної гіалуронової кислоти. Для отримання механічно та хімічно більш стійких матеріалів були розроблені різні хімічні модифікації. Фізико-хімічні властивості одержаних похідних ГК можуть значно відрізнятися від властивостей природного полімеру, проте більшість похідних зберігають біосумісність та здатність до біодеградації та, в деяких випадках, фармакологічні властивості природної ГК.
Для пролонгації присутності ГК у тканинах використовуються різні варіанти зшивання ланцюгів ГК один з одним. Найчастіше це варіанти зшивання від ланцюга до ланцюга. Для отримання молекулярних мостів між ланцюжками ГК у багатьох хімічних реакціях використовують агенти зшивання, так звані «спейсери». Як «спейсери» можуть виступати бікарбодіїміди, дивінілсульфон, бігідразиди, біепоксиди. А ділянками зшивання можуть бути як карбоксильні, так і гідроксильні групи. На Рис. 1 та 2 схематично представлені реакції зшивання молекул ГК на основі гідроксильних та карбоксильних груп.
У більшості дермальних філерів на основі ГК використовуються саме такі зв’язки. Присутність зв’язків із залученням молекулярних спейсерів змінює катаболізм ГК. Время разложения подобных полимеров существенно увеличивается. А продуктами катаболізму будуть лише монота дисахариди.
Гіалуронові кислоти, стабілізовані поперечними зв’язками, завдяки хімічним агентам втрачають специфічну активність.
Початок цього століття ознаменувався появою нових технологій та продуктів. Особливе місце серед них посіли ефіри ГК. У 1987 році італійський концерн Fidia Farmaceutici SpA створив модифікацію ГК за технологією auto-cross link HA ether ефір ГК на основі внутрішньомолекулярних перехресних зв’язків. Нова модифікація одержала назву АСР (autocrosslinked polysaccharide). У молекулі АСР формуються внутрішні ефірні зв’язки між карбоксильними та гідроксильними групами сусідніх ланцюгів гіалуронової кислоти без участі стороннього хімічного агента (рис. 3).
Утворені зв’язки неміцні: у присутності води та неспецифічних тканинних ферментів естераз хімічно трансформовані молекули ГК піддаються реакції деетерифікації, і нативна структура введеної ГК повністю відновлюється. Так як реакція потребує деякого часу, відновлення ГК відбувається поступово і процес резорбції дещо сповільнюється. Тим самим у шкірі створюється депо активної ГК. У 1989 році компанія отримала патент на винахід, і аж до 1994 року вивчалися фізико-хімічні характеристики цього полімеру та залежність його в’язкості від числа внутрішньомолекулярних ефірних зв’язків. У процесі дослідження було визначено оптимальний відсоток зшивання молекул ГК. Цей показник визначається як число повторюваних одиниць ГК, що беруть участь в реакції етерифікації. При ступені зшивання 2-15% полімер ACP здатний поглинати різну кількість вологи, тобто розбухати різною мірою. Ступінь розбухання варіюється від 1000 (при низькому ступені зшивання) до 10 і менше (при високому ступені зшивання) і визначається як відношення розміру (ваги) розбухлого гідрогелю до розміру (ваги) сухого продукту (Рис. 4).
Іншими словами, чим вищий ступінь зшивання, тим менше вологи поглинає гідрогель. А чим менший ступінь зшивання, тим більше вологи притягує гель, що може спричинити набряк тканин. Для ін’єкційного матеріалу оптимальний ступінь зшивання становить від 4 до 6%. В АСР ступінь зшивання дорівнює 5% і означає: 5 ефірних зв’язків на кожні 100 одиниць ГК.
Механічні властивості, такі як динамічна в’язкість, мають пряму кореляцію зі ступенем зшивання. При високому ступені зшивання спостерігається недостатність пластичності, що ускладнює застосування полімеру у формі ін’єкцій. Отже, полімер ACP зі ступенем зшивання 5% має такі якісні характеристики:
– розбухає у водних розчинах;
– має оптимальну в’язкість;
– відповідає системам введення (шприци та голки).
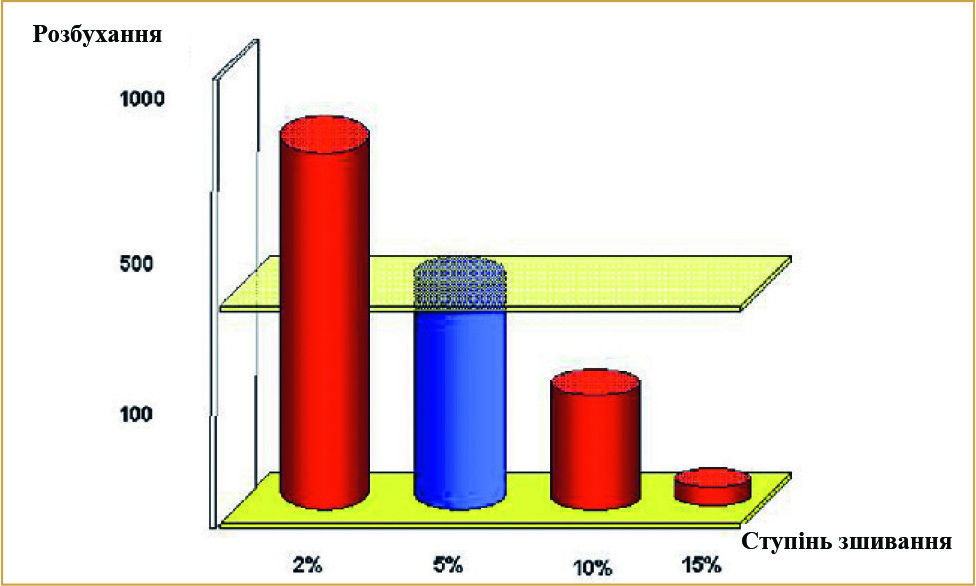
(Рис. 4) Ступені зшивання до ступеня розбухання
5. БІОМАТЕРІАЛИ, СТВОРЕНІ НА ОСНОВІ ГК
А. Матеріали, отримані за допомогою реакції внутрішньомолекулярної етерифікації
З кінця дев’яностих років починається промислове виробництво препаратів на основі ефіру ГК АСР для медичних потреб. Fidia Farmaceutici SpA (Італія) розробляє препарати для медичного застосування з метою запобігання спайковим процесам у нейрохірургії Hyalogelide® та в абдомінальній хірургії Hyalobarrier® gel.
Наприкінці 2005 року на європейський косметичний ринок виходить ін’єкційний препарат для біоревіталізації Ial-System ACP®, що містить 2% ГК у вигляді ефіру. Препарат випускається у шприцах по 1 мл. Техніка введення – мікроін’єкції
В середньо-глибокий шар дерми (на глибину 3-4 мм) під кутом 45° (див. фото).
«Життєвий цикл» матеріалу Ial-System ACP® проходить у тканинах 3 фази.
Перша фаза – введення препарату та його первинний розподіл.
Друга фаза – гідроліз, під час якого складноефірні зв’язки розпадаються з утворенням вихідної форми ГК. При цьому об’єм препарату не зменшується, а його здатність до утримання вологи тільки наростає. Цей процес досить повільний та протікає у напрямку від периферії до центру із залученням все нових порцій води. Швидкість реакції гідролізу визначає тривалість другої стадії.
Третя фаза – руйнація ГК: нативна гіалуронова кислота, що вивільняється, піддається впливу гіалуронідази, яка руйнує полімер до коротких ланцюгів і олігосахаридів. Проміжні продукти деградації стимулюють фізіологічну регенерацію, яка закладає основи перетворення позаклітинного матриксу [7]. Такий механізм біодеградації препарату дозволяє продовжити час його присутності в тканині.
Препарат реалізує всі властивості природної ГК, забезпечуючи відновлення якісного позаклітинного матриксу, ефективну стимуляцію фібробластів, гідратуючу та антиоксидантну дії, стимуляцію ангіогенезу [7–9].
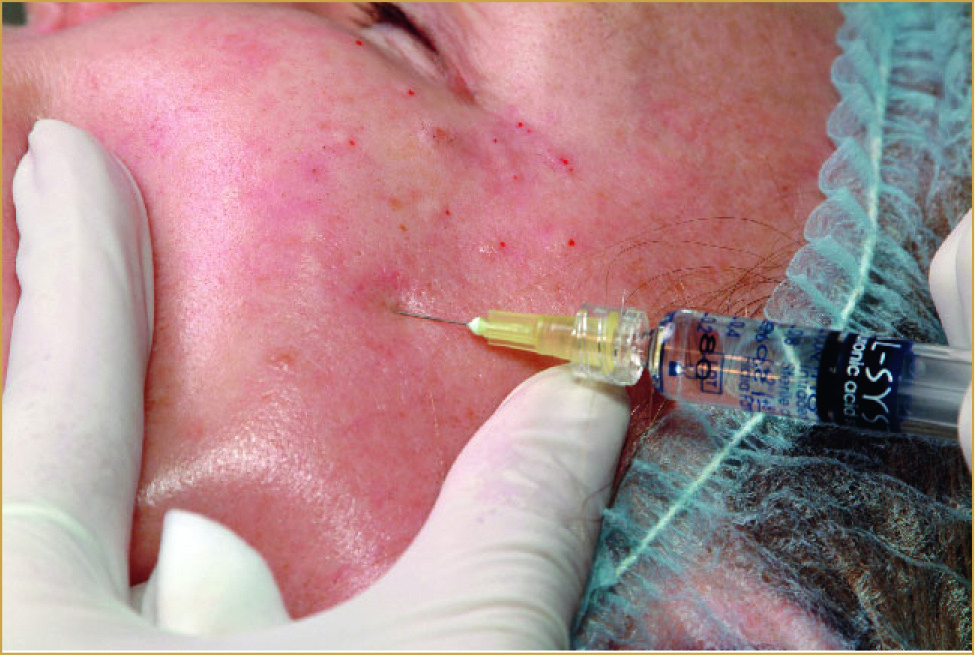
Фото. Техніка введення препарату Ial-System ACP®
Б. Матеріали на основі технології HYAFF®
Матеріали на основі ефіру ГК широко застосовуються у відновлювальній медицині.
Технологія HYAFF® (Fidia Inc, Італія) дозволила одержувати ефіри ГК з різними спиртами. Кінцевий продукт не розчиняється у воді і дозволяє створювати нитки, листи та графти для заміщення хряща, кістки та шкіри.
Для загоєння та захисту ран було розроблено нові напівсинтетичні замінники шкіри, здатні прискорювати процес відновлення тканини. До останніх розробок належить новий клас біо-матеріалів – мембрани HYAFF®. Для лікування опікових ран у дітей та як тимчасовий замінник дерми після дермабразії застосовують препарат Hyalomatrix® PA.
Hyalomatrix® PA розроблений на основі бензилового ефіру ГК за технологією HYAFF® і в теперішній час використовується в Європі (Італії, Іспанії, Великій Британії, Греції, Швейцарії, Франції), в Південній Кореї, Ізраїлі та Туреччині.
Hyalomatrix® PA являє собою двошарову стерильну еластичну ранову пов’язку. Контактуючий з поверхнею рани шар HYAFF® дозволяє використовувати переваги гіалуронової кислоти з тривимірною структурою молекули. У сформований таким чином простір проникають фібробласти та компоненти позаклітинного матриксу, сприяючи нормальному відновленню дерми. Крім цього, пов’язка Hyalomatrix® PA має такі властивості: вона стає в’язкою і створює сприятливе для загоєння рани середовище; прозорість еластомірної плівки дозволяє контролювати процес загоєння без необхідності змінювати пов’язку; силіконова мембрана є напівпроникною перешкодою для зовнішніх збудників та перешкоджає висушуванню рани.
За технологією HYAFF® була також розроблена група «біоінтерактивних» пов’язок Hyalofill®, Hyalogran®, Jaloskin®. Ці пов’язки сприяють процесу загоєння рани, здійснюючи прямий чи опосередкований вплив на клітинну проліферацію, клітинну міграцію, звільнення цитокінів.
Ранові покриття на основі ефіру ГК сприяють не лише швидкості, але й якості загоєння. Утворюється фізіологічний епітелій з морфофункціональними характеристиками, подібними до характеристик здорової шкіри.
6. ВИСНОВОК
Властивості ГК дозволяють використовувати її в різних галузях медицини та косметології, і спектр її застосування безперервно розширюється.
На сьогоднішній день велика кількість продуктів на основі ГК вже випущена на ринок, і в найближче десятиліття очікується їх схвалення та введення в практику нових і нових медичних продуктів і ліків, що включають біоматеріали, створені на основі гіалуронової кислоти.
- Кантор Ч, Шиммел П. Биофизическая химия. Пер. с англ. М., 1984.
- Laurent TC, ed. The Chemistry, Biology and Medical Applications of Hyaluronan and its Derivatives. London: Portland Press, 1998; Wenner-Gren International Series, Vol 72.
- Бычков СМ, Кузьмина СА. Биологическая роль гиалуроновой кислоты (обзор). Вопросы мед. химии 1986;32(1):19–32.
- Mitchell P. Hyaluronan in skin. J Intern Med 1997;242:61–66.
- Строителев В, Федорищев И. Гиалуроновая кислота в медицинских и косметических препаратах. Косметика & медицина 2000;(3):21–31.
- Костина Г. Радаева И. «Использование гиалуроновой кислоты в медицине и косметологии». Косметика & медицина 1999;(2-3):53–57.
- Alessandrini A, Di Bartolo C. ACP gel: a new hyaluronic acid-based injectable for facial rejuvenation. Preclinical data in a rabbit model. Plast Reconstr Surg 2006;118(2):341–346.
- Di Pietro A, Di Sante G. II recupero dell`elasticita e del turgore cutaneo mediante iniezione intradermica di acido ialuronico (Ial-System). II Giornale Italiano di Dermatologia e Venerologia 2001;6:187–191.
- Тубинис Е. Что такое биоревитализация кожи? LNE 2003,(5):5–58.
