О. Гришо, кандидат фармацевтических наук Л. Камелина, врач-дерматовенеролог высшей категории
1. ВВЕДЕНИЕ
Гиалуроновые кислоты (ГК, синоним – гиалуронан) – группа кислых гликозаминогликанов – высокомолекулярных линейных биополимеров, молекулы которых построены из чередующихся остатков D-глюкуроновой кислоты и N-ацетил-D-глюкозамина, соединенных β-(1→4)и β-(1→3)-связями. Широко представлены в тканях человека и животных, где являются важнейшим компонентом основного вещества соединительной ткани, синовиальной жидкости, стекловидного тела; в больших количествах обнаружены в пупочном канатике, коже, оболочках яйцеклеток, а также в роговице, костях, клапанах сердца [1].
Несмотря на относительно простое химическое строение, ГК обладают удивительными свойствами. После открытия ГК в 1934 году предполагалось, что эта группа веществ влияет на формирование биофизических и гомеостатических свойств тканей. Однако последующие исследования показали, что ГК играют одну из ключевых ролей в межклеточных взаимодействиях. Как «цементирующие» компоненты основного вещества соединительной ткани ГК влияют на ее проницаемость, определяют барьерную и защитную функции межклеточного матрикса.
Широкий спектр биологической активности, отсутствие антигенности при высокой биосовместимости с тканями и средой человеческого организма, возможность целенаправленной модификации свойств – все эти факторы обусловили широкое применение различных препаратов и изделий на основе ГК в медицине и косметологии.
2. СВОЙСТВА ГИАЛУРОНОВОЙ КИСЛОТЫ
С эволюционной точки зрения, гиалуроновая кислота является древней молекулой. Молекулярная масса ГК очень велика и составляет 0,086х106–10х106 Да. Она легко связывают воду (одна молекула ГК удерживает 200–500 молекул воды) и образуют очень вязкие растворы, в которых молекулы этих кислот могут формировать замкнутые трехмерные структуры. Высокая плотность отрицательных зарядов ГК притягивает катионы, такие как Na+, К+, Са2+ и Мg2+, которые являются осмотически активными и вызывают поступление большого количества воды в матрикс. ГК связывают интерстициальную воду в межклеточных пространствах, повышая тем самым сопротивление тканей сжатию (в противоположность коллагеновым фибриллам, которые обуславливают резистентность матрикса к силам растяжения), участвуютв ионном обмене, транспорте и распределении воды в тканях. С основаниями ГК дают соли, с белками вступают в ковалентную связь, теряя при этом способность растворяться в воде при кислых значениях рН и образуя так называемые муциновые сгустки [1].
Как отмечалось выше, ГК входят в число основных компонентов таких естественных жидкостей, как стекловидное тело человеческого глаза (0,1–0,4 мг/г во влажном состоянии); синовиальная жидкость (3–4 мг/мл); матрикс, образованный скоплением клеток вокруг ооцита перед овуляцией (~0,5 мг/мл); патологический матрикс, который закупоривает артерию при коронарном рестенозе. Несмотря на то, что массовая доля ГК в ткани невелика, она является основным структурным элементом матрикса. Например присутствует в гиалиновых хрящах (~1 мг/г во влажном состоянии) в достаточном количестве, чтобы заполнить объем ткани при отсутствии других компонентов. В меньшей степени ГК присутствует в матриксе других соединительных тканей, например, в тканях, окружающих клетки гладкой мускулатуры в аорте, и фибробластах в дерме кожи. Однако, как и в хрящевой ткани, в матриксах этих тканей ГК образует каркас для сцепления крупных молекул хондроитинсульфата протеогликана [2].
ГК (в очень малой концентрации) взаимодействуют с некоторыми клетками, обнаруживая при этом высокую специфичность и запуская важные ответные реакции. Многие клетки обладают рецепторами к ГК [3].
ГК имеют черты, которые, как считает доктор Mitchell [4], свойственны молекулам-«транспортерам», переносящим химические соединения через мембраны клеток.
Синтез ГК происходит в мезенхимальных тканях, по-видимому, в молодых фибробластах и тучных клетках. Однако весь процесс биосинтеза ГК, особенно полимеризация, до конца не выяснен. Установлено, что N-ацетилглюкозамин и D-глюкуроновая кислота, из которых строятся молекулы ГК, образуются из глюкозы, а аминогруппы (NH2-группы) ГК принадлежат глутамину. Обмен ГК в организме совершается быстро – период биологической полужиз ни их молекул составляет около двух суток. Регулируется обмен ГК гормонами щитовидной и половых желез, кортизоном, адренокортикотропным гормоном и др. Катаболизируются ГК при помощи ферментов гиалуронидаз, катализирующих гидролиз и деполимеризацию этих кислот. Гиалуронидазы содержатся практически во всех органах и тканях человека и других млекопитающих (особенно много их в яичках, сперме и яичниках), в тканях быстро растущих опухолей, в плазматических мембранах патогенных микроорганизмов.[1].
3. ПРИМЕНЕНИЕ ГИАЛУРОНОВЫХ КИСЛОТ В МЕДИЦИНЕ
Гиалуроновые кислоты являются привлекательным строительным материалом для создания новых биосовместимых и биодеградируемых полимеров, которые можно применять для доставки лекарств к тканям, в биоинженерии тканей, для ускорения заживления ран, формирования постхирургических рубцов, в офтальмологии и в ортопедии.
ГК служат для контролируемой доставки и высвобождения лекарств. Лекарственные препараты ковалентно или нековалентно связываются с гиалуронатами (солями ГК). Гиалуронаты создают депо препарата в месте инъекции и, постепенно разрушаясь, высвобождают лекарство, улучшая его фармакологический профиль и предупреждая развитие возможных побочных реакций.
ГК применяют как средство для любого вида внутрисуставного лечения, а также с целью защиты суставного хряща от возможного неблагоприятного воздействия используемого лекарственного препарата. Было доказано, что ГК пролонгируют эффект лекарственных средств, уменьшая их диффузию из суставного пространства [5].
Еще одной областью использования ГК стала артропластика, а также остеотомия и все типы внутрисуставных операций, где ГК предотвращают избыточное фиброзирование и способствуют нормальному заживлению тканей.
То обстоятельство, что гиалуроновые кислоты обладают дезинфицирующим, ранозаживляющим и регенерирующим действиями, позволило создать эффективные препараты для лечения ожогов и лучевых поражений кожи. ГК оказывают выраженное биостимулирующее действие при длительно не заживающих трофических язвах. Подкожное и местное введение ГК предотвращает образование грануляционных тканей, спаек, рубцов, нормализует кровоснабжение.
В последние годы растет популярность защитных раневых покрытий, содержащих ГК. Преимущества использования таких покрытий очевидны. Во-первых, они легко разрушаются и выводятся из организма; во-вторых, ГК иммунонейтральны и, следовательно, не могут спровоцировать воспалительную или аллергическую реакции; в-третьих, из ГК достаточно легко получить полупроницаемые защитные покрытия, обеспечивающие хороший газообмен в ране. Известны полимерные покрытия, содержащие помимо ГК противовоспалительный агент. Такие покрытия не только изолируют раневую поверхность, но и оказывают на нее пролонгированное лечебное воздействие [6].
ГК, обладая мощным регенерирующим действием, предотвращают образование грануляционных тканей, спаек, рубцов; нормализуют кровообращение, восстанавливают иммунные реакции кожи, нормализуют метаболизм и обменные процессы в коже.
Одной из причин пристального внимания исследователей к ГК является их способность влиять на поведение клетки. Это связано, во-первых, с ключевой ролью гиалуроновых кислот в организации внеклеточного матрикса, а во-вторых, с их свойством рецепторопосредованно взаимодействовать с клетками.
Впоследнее десятилетие ГК стали широко применяться и в эстетической медицине. Материалы на основе ГК используют для коррекции морщин (филлеры) и для восстановления тургора и эластичности кожи (биоревитализация). В филлерах используют стабилизированные (или модифицированные) ГК. На сегодняшний день филлеры на основе ГК оказались самыми физиологичными и безопасными.
В биоревитализации применяют немодифицированные ГК с определенными параметрами. Процедуры увлажнения и биоревитализации с использованием инъекций немодифицированных ГК относят к числу самых эффективных методов, восстанавливающих качество кожи физиологическим путем.
В последнее время появился новый класс биоревитализаторов на основе внутреннего эфира ГК. В рамках этой статьи будет предпринята попытка познакомить читателя с различными модификациями ГК.
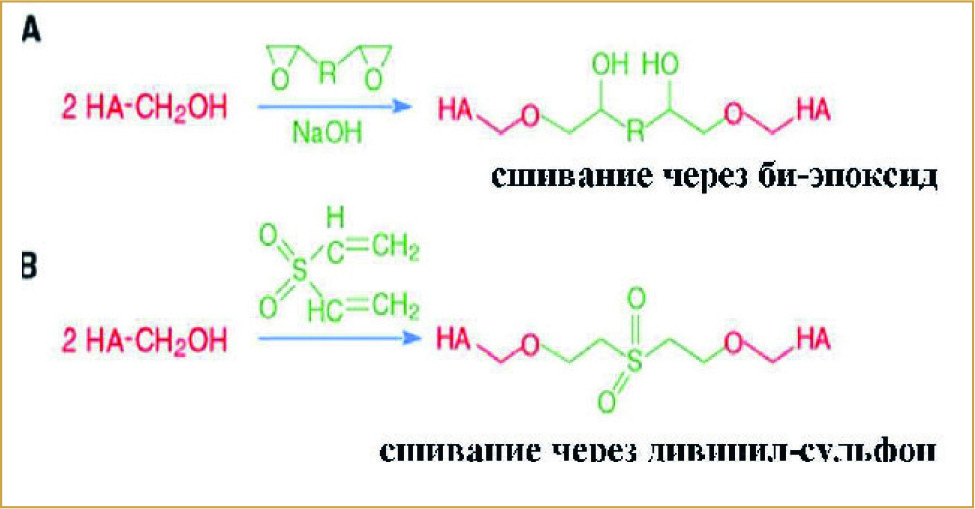
(Рис. 1) Сшивание на основе гидроксильной группы
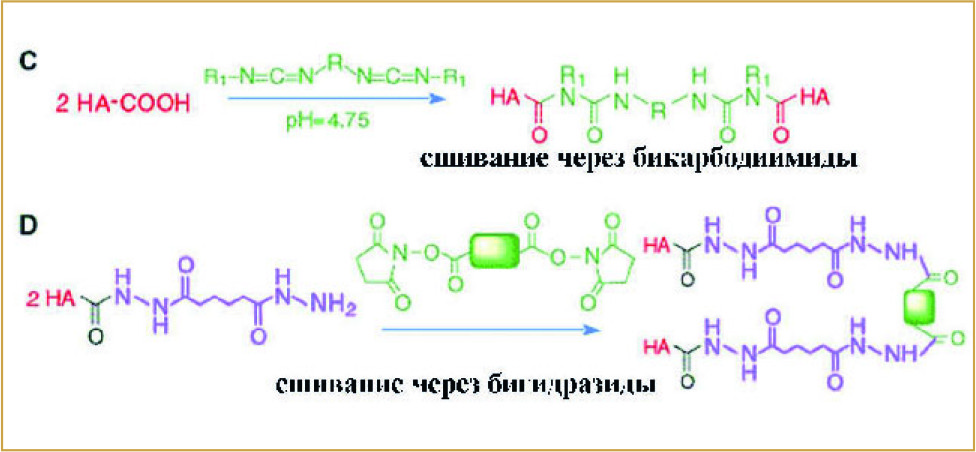
(Рис. 2) Сшивание на основе карбоксильной группы

(Рис. 3) Образование внутренних сложно-эфирных связей в молекуле АСР
1 стадия – реакция ионного обмена (ТВА – тетрабутиламоний); 2 стадия – образование промежуточного вещества (активного эфира) при реакции ГК с конденсационным агентом (CMPJ – хлорметилпиридиниодид); 3 стадия – реакция нуклеофильного замещения, приводящая к сшиванию между цепочками одной и той же молекулы ГК с образованием внутримолекулярной эфирной связи
4. ВИДЫ ХИМИЧЕСКИХ МОДИФИКАЦИЙ ГИАЛУРОНОВЫХ КИСЛОТ
До недавнего времени задача создания материала на основе ГК, который оставался бы в коже длительное время и при этом сохранял свою специфическую биологическую активность, оставалась нерешенной. Проблема заключалась в том, что нативные ГК (даже с очень высоким молекулярным весом) подвергаются относительно быстрой резорбции.
Созданию новых биоматериалов препятствуют слабые биомеханические свойства природной гиалуроновой кислоты. Для получения механически и химически более устойчивых материалов были разработаны различные химические модификации. Физико-химические свойства полученных производных ГК могут значительно отличаться от свойств природного полимера, однако большинство производных сохраняют биосовместимость и способность к биодеградации и, в некоторых случаях, фармакологические свойства природной ГК.
Для пролонгации присутствия ГК в тканях используются различные варианты сшивания цепей ГК друг с другом. Чаще всего это варианты сшивания от цепи к цепи. Для получения молекулярных мостов между цепочками ГК во многих химических реакциях используют агенты сшивания, так называемые «спейсеры». В качестве «спейсеров» могут выступать бикарбодиимиды, дивинилсульфон, бигидразиды, биэпоксиды. А участками сшивания могут служить как карбоксильные, так и гидроксильные группы. На рис. 1 и 2 схематично представлены реакции сшивания молекул ГК на основе гидроксильных и карбоксильных групп.
В большинстве дермальных филлеров на основе ГК используются именно такие связи. Присутствие связей с вовлечением молекулярных спейсеров меняет катаболизм ГК. Время разложения подобных полимеров существенно увеличивается. А продуктами катаболизма будут только монои дисахариды.
Гиалуроновые кислоты, стабилизированные поперечными связями, благодаря химическим агентам утрачивают специфическую активность.
Начало этого столетия ознаменовалось появлением новых технологий и продуктов. Среди них особое место заняли эфиры ГК. В 1987 году итальянский концерн Fidia Farmaceutici SpA создал модификацию ГК по технологии auto-cross link HA ether (эфир ГК на основе внутримолекулярных перекрестных связей). Новая модификация получила название АСР (autocrosslinked polysaccharide). В молекуле АСР формируются внутренние эфирные связи между карбоксильными и гидроксильными группами соседних цепей гиалуроновой кислоты без участия постороннего химического агента (рис. 3).
Образовавшиеся связи непрочны: в присутствии воды и неспецефических тканевых ферментов эстераз химически трансформированные молекулы ГК подвергаются реакции деэтерификации, и нативная структура введенной ГК полностью восстанавливается. Так как данная реакция требует некоторого времени, восстановление ГК происходит постепенно и процесс резорбции несколько замедляется. Тем самым, в коже создается депо активной ГК.
В 1989 году компанией был получен патент на изобретение, и вплоть до 1994 года изучались физико-химические характеристики данного полимера и зависимость его вязкости от числа внутримолекулярных эфирных связей. В процессе исследования был определен оптимальный процент сшивания молекул ГК. Этот показатель определяется как число повторяющихся единиц ГК, участвующих в реакции этерификации. При степени сшивания 2–15% полимер ACP способен поглощать разное количество влаги, то есть разбухать в разной степени. Степень разбухания варьируется от 1000 (при низкой степени сшивания) до 10 и менее (при высокой степени сшивания) и определяется как отношение размера (веса) разбухшего гидрогеля к размеру (весу) сухого продукта (рис. 4).
Иными словами, чем выше степень сшивания, тем меньше влаги поглощает гидрогель. А чем меньше степень сшивания, тем больше влаги привлекает гель, что может стать причиной отека тканей. Для инъекционного материала оптимальная степень сшивания составляет от 4 до 6%. В АСР степень сшивания равна 5% и означает: 5 эфирных связей на каждые 100 единиц ГК.
Механические свойства, такие как динамическая вязкость, имеют прямую корреляцию со степенью сшивания. При высокой степени сшивания наблюдается недостаточность пластичности, что осложняет применение полимера в виде инъекций.
Итак, полимер ACP со степенью сшивания 5% обладает следующими качественными характеристиками:
– разбухает в водных растворах;
– обладает оптимальной вязкостью;
– соответствует системам введения (шприцы и иглы).
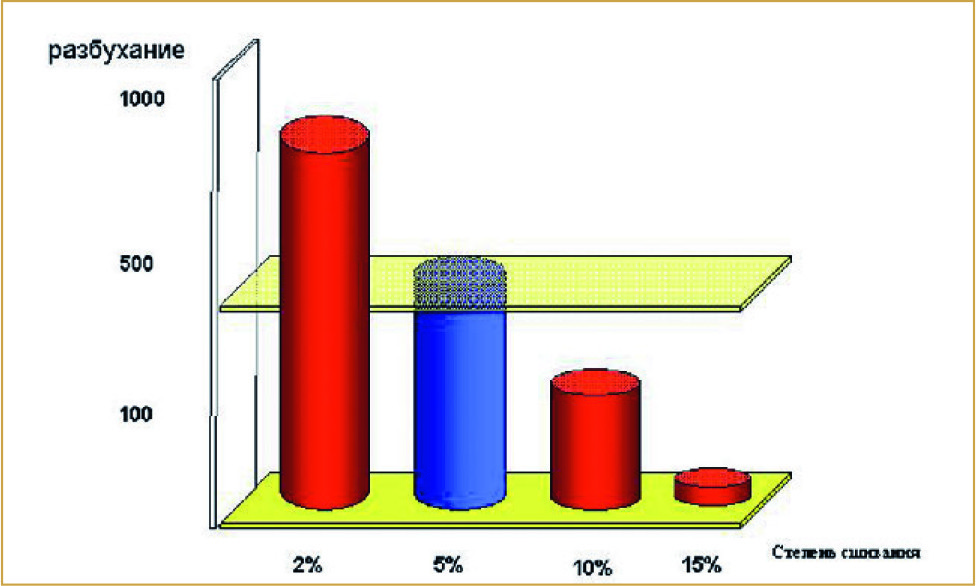
(Рис. 4) Степени сшивания к степени разбухания
5. БИОМАТЕРИАЛЫ, СОЗДАННЫЕ НА ОСНОВЕ ГК
А. Материалы, полученные с помощью реакции внутримолекулярной этерификации
С конца девяностых годов начинается промышленное производство препаратов на основе эфира ГК АСР для медицинских целей. Fidia Farmaceutici SpA (Италия) разрабатывает препараты для медицинского применения с целью предотвращения спаечных процессов в нейрохирургии Hyalogelide® и в абдоминальной хирургии Hyalobarrier® gel.
В конце 2005 года на европейский косметический рынок выходит инъекционный препарат для биоревитализации Ial-System ACP®, содержащий 2% ГК в виде эфира. Препарат выпускается в шприцах по 1 мл. Техника введения – микроинъекции в средне-глубокий слой дермы (на глубину 3–4 мм) под углом 45° (см. фото).
«Жизненный цикл» материала Ial-System ACP® проходит в тканях 3 фазы.
Первая фаза – введение препарата и его первичное распределение.
Вторая фаза – гидролиз, во время которого сложноэфирные связи распадаются с образованием исходной формы ГК. При этом объем препарата не уменьшается, а его влагоудерживающая способность только нарастает. Этот процесс достаточно медленный, протекает в направлении от периферии к центру с привлечением все новых и новых порций воды. Скорость реакции гидролиза определяет продолжительность второй стадии.
Третья фаза – разрушение ГК: высвобождающаяся нативная гиалуроновая кислота подвергается воздействию гиалуронидазы, которая разрушает полимер до коротких цепей и олигосахаридов. Промежуточные продукты деградации стимулируют физиологическую регенерацию, которая и закладывает основы преобразования внеклеточного матрикса [7]. Такой механизм биодеградации препарата позволяет продлить время его присутствия в ткани.
Препарат реализует все свойства природной ГК, обеспечивая восстановление качественного внеклеточного матрикса, эффективную стимуляцию фибробластов, гидратирующее и антиоксидантное действия, стимуляцию ангиогенеза [7–9].
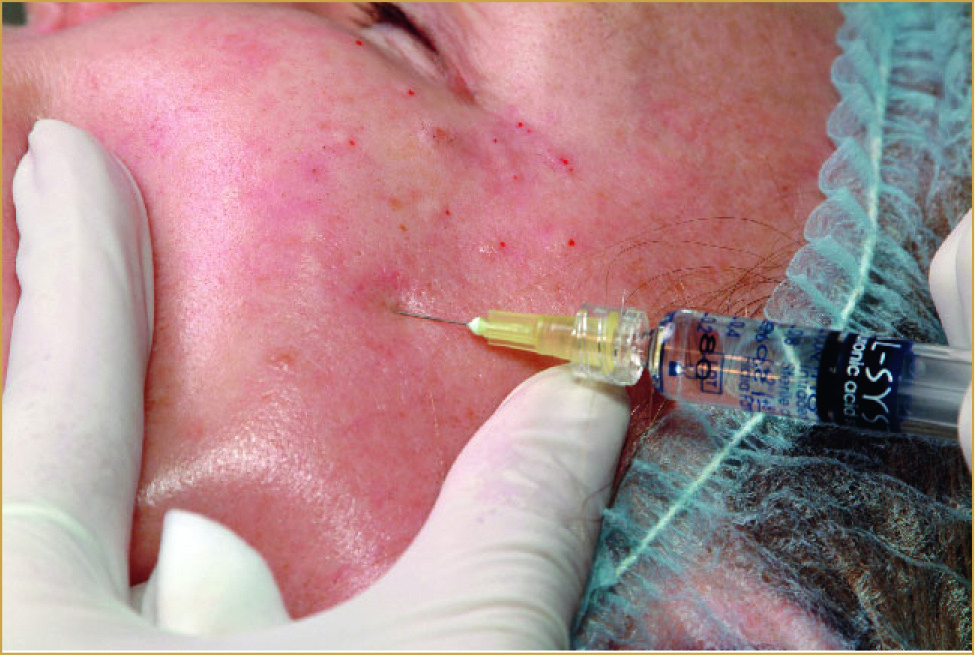
Фото. Техника введения препарата Ial-System ACP®
Б. Материалы на основе технологии HYAFF®
Материалы на основе эфира ГК широко примененяются в восстановительной медицине.
Технология HYAFF® (Fidia Inc, Италия) позволила получать эфиры ГК с различными спиртами. Конечный продукт не растворяется в воде и позволяет создавать нити, листы и графты для замещения хряща, кости и кожи.
Для заживления и защиты ран были разработаны новые полусинтетические заменители кожи, способные ускорять процесс восстановления ткани. К последним разработкам относится новый класс биоматериалов – мембраны HYAFF®. Для лечения ожоговых ран у детей и в качестве временного заменителя дермы после дермабразии применяют препарат Hyalomatrix® PA.
Hyalomatrix® PA разработан на основе бензилового эфира ГК по технологии HYAFF® и в настоящее время используется в Европе (Италии, Испании, Великобритании, Греции, Швейцарии, Франции), в Южной Корее, Израиле и Турции. Hyalomatrix® PA представляет собой двухслойную стерильную эластичную раневую повязку. Контактирующий с поверхностью раны слой HYAFF® позволяет использовать преимущества гиалуроновой кислоты c трехмерной структурой молекулы. В сформированное таким образом пространство проникают фибробласты и компоненты внеклеточного матрикса, способствуя нормальному восстановлению дермы. Кроме этого, повязка Hyalomatrix® PA обладает следующими свойствами: она становится вязкой и создает благоприятную для заживления раны среду; прозрачность эластомерной пленки позволяет контролировать процесс заживления без необходимости менять повязку; силиконовая мембрана является полупроницаемой преградой для внешних возбудителей и препятствует высушиванию раны.
По технологии HYAFF® была также разработана группа «биоинтерактивных» повязок Hyalofill®, Hyalogran®, Jaloskin®. Эти повязки способствуют процессу заживления раны, оказывая прямое или косвенное влияние на клеточную пролиферацию, клеточную миграцию, освобождение цитокинов.
Раневые покрытия на основе эфира ГК способствуют не только скорости, но и качеству заживления. Создается физиологический эпителий с морфо-функциональными характеристиками, схожими с характеристиками здоровой кожи.
6. ЗАКЛЮЧЕНИЕ
Свойства ГК позволяют использовать ее в различных областях медицины и косметологии, и спектр ее применения непрерывно расширяется.
На сегодняшний день большое количество продуктов на основе ГК уже выпущены на рынок, и в ближайшее десятилетие можно ожидать их одобрения и введения в практику все новых и новых медицинских продуктов и лекарств, включающих созданные на основе гиалуроновой кислоты биоматериалы.
Литература
- Кантор Ч, Шиммел П. Биофизическая химия. Пер. с англ. М., 1984.
- Laurent TC, ed. The Chemistry, Biology and Medical Applications of Hyaluronan and its Derivatives. London: Portland Press, 1998; Wenner-Gren International Series, Vol 72.
- Бычков СМ, Кузьмина СА. Биологическая роль гиалуроновой кислоты (обзор). Вопросы мед. химии 1986;32(1):19–32.
- Mitchell P. Hyaluronan in skin. J Intern Med 1997;242:61–66.
- Строителев В, Федорищев И. Гиалуроновая кислота в медицинских и косметических препаратах. Косметика & медицина 2000;(3):21–31.
- Костина Г. Радаева И. «Использование гиалуроновой кислоты в медицине и косметологии». Косметика & медицина 1999;(2-3):53–57.
- Alessandrini A, Di Bartolo C. ACP gel: a new hyaluronic acid-based injectable for facial rejuvenation. Preclinical data in a rabbit model. Plast Reconstr Surg 2006;118(2):341–346.
- Di Pietro A, Di Sante G. II recupero dell`elasticita e del turgore cutaneo mediante iniezione intradermica di acido ialuronico (Ial-System). II Giornale Italiano di Dermatologia e Venerologia 2001;6:187–191.
- Тубинис Е. Что такое биоревитализация кожи? LNE 2003,(5):5–58.
