Базова проблематика. Як лікування для омолодження шкіри було запропоновано нову рецептуру гіалуронової кислоти за технологією auto-cross-link із поперечним міжмолекулярним зв’язком (ГК-ACP). Мета цього проспективного пілотного дослідження – вивчити її переносимість та ефективність при лікуванні старіння шкіри в області декольте.
Андреа Алессандріні, доктор естетичної медицини, фахівець з судинної хірургії, професор Римського університету La Sapienza, голова відділу ангіології Міністерства охорони здоров’я

Методи. У дослідженні брали участь п’ятнадцять жінок (середнього віку 49,0±8,0 (діапазон 30-65)), які скаржилися на стан шкіри в області декольте. Їм було проведено курс з трьох процедур внутрішньо-шкірних ін’єкцій ГК-ACP (IALSYSTEM ACP) – кожен з інтервалом у три тижні. Контрольні обстеження проводилися через 80 та 120 днів з моменту реєстрації. Ефект омолодження оцінювали за шкалою Біглі-Гібсона та Фебі-Болтона. Дослідники та пацієнти також суб’єктивно оцінювали зовнішній вигляд шкіри за десятибальною шкалою. Омолоджуючий ефект та його переносимість оцінювалися шляхом зіставлення балів, зібраних у різні контрольні відрізки часу, за допомогою рангових критеріїв Вілкоксона. Побічні ефекти та їх тривалість були зареєстровані та порівняні з даними, зазначеними в літературі. Результати. Рецептура ГК-ACP забезпечувала значне поліпшення за шкалою Біглі-Гібсона (p < 0,005) у всі контрольні відрізки часу. Під час обстеження на 120-й день дослідження показник Фабі-Болтона було значно покращено порівняно з вихідним рівнем (p < 0,05). Омолоджуючий ефект зберігався між контрольними обстеженнями на 80-й та 120-й дні. Під час спостереження на 120 день суб’єктивні оцінки дослідників і пацієнтів становили від 8 до 10 балів. Непередбачені побічні ефекти не спостерігалися. Всі побічні ефекти добре переносилися учасниками та проходили протягом короткого періоду часу.
Висновки. Лікування рецептурою ГК-ACP під наглядом є безпечним, добре переносимим і забезпечує ефективне та тривале омолодження зони декольте.
Вступ
Ознаки старіння особливо помітні в ділянці декольте, і попит на омолодження грудей зростає [1, 2]. Епідерміс та дерма в області декольте тонші, ніж в інших областях, таких як обличчя [1, 3], підшкірної жирової тканини та сальних залоз менше [2, 4]. Крім того, декольте постійно піддається дії м’яза платизму [5], що призводить до утворення зморшок у ділянці шиї, а також у середній та глибокій грудній клітці [6]. Ці фактори впливають на старіння шкіри в ділянці декольте [7] і роблять її омолодження складним у частині переносимості та ефективності.
Старіння шкіри спричиняється двома факторами: інтервалом часу (внутрішнє старіння) та змінами від сонячного впливу (зовнішнє старіння) [8, 9]. Внутрішнє старіння, спричинене клітинним старінням, призводить до згладжування дермоепідермального з’єднання (DEJ) та зменшення товщини дерми. Внутрішньо постаріла шкіра характеризується сухістю, тонкістю та пізньою появою дрібних зморшок. [2]. Навпаки, шкіра, що постаріла зовнішньо, характеризується швидкою деградацією і зміною екстрацелюлярної матриці (ECM), викликаної активацією металопротеїнів (MMP) і підвищеною стимуляцією від впливу ультрафіолетових променів. Як наслідок, шкіра від фотостаріння стаєгрубою, пухкою та зморшкуватою [10, 11]. Ці два процеси є накопичувальними і призводять до значних змін структури та щільності колагену, глікозакоміногліканів (GAG) та еластичних волокон в папілярній та ретикулярній дермі [12-14]. Внаслідок старіння шкіра втрачає свою здатність утримувати вологу з часом, стає грубішою і менш пружною [15]. Крім впливу на глікозакоміноглікани (GAG), процес старіння істотно посилює біосинтез гіалуронової кислоти (ГК) [16-18].
ГК являє собою полісахарид, що складається з повторюваних ланок дисахаридів.
D-глюкуронової кислоти та N-ацетил-D-глюкозаміну, що в екстрацелюлярній матриці ЕЦМ сполучних тканин зв’язується з протеогліканами, фібронектином та колагеном. ГК підтримує об’єм та водний баланс шкіри [19]. ГК має потужну гідрофільну властивість [20], розчиняється у воді для утворення в’язких гелів [21, 22]. Тому ГК часто використовується як ін’єкційна сполука для відновлення пружності шкіри, а також коригування зморшок та складок шкіри [22]. ГК може піддаватися певній мірі поперечного зшивання [23] з метою пом’якшення її реологічних та водоутримуючих властивостей, а також підвищення часу її деградації [22]. Характер реагентів, що використовуються для поперечної зшивки ГК, ступені зшивання та тип міжта внутрішньомолекулярних зв’язків, які можуть бути створені, дуже різні [24, 25], а «оптимальний» ступінь зшивання ще не визначений [26]. Відповідно, стійкість, переносимість та загальний потенціал різних зшитих формул повинні оцінюватися в кожному конкретному випадку [27].
Нещодавно було запропоновано низку рецептур на основі ГК (IAL-System, Fidia, АбаноТерме, Італія) для омолодження зморшок, починаючи від дрібних до глибоких, що потребують постійного збільшення обсягу [28, 29]. Одна з таких рецептур (IAL-System ACP, надалі скорочено ГК-ACP) містить ГК, яка піддається реакції автозшивання для створення між-і внутрішньомолекулярних зв’язків між мономерами ГК [30, 31]. Будучи автоматично зшитою, ГК-ACP не містить залишкових хімічних речовин і піддається повільному розпаду, що підвищує показники її безпеки.
Було показано, що ГК-ACP катаболізується через фізіологічний шлях розпаду ГК, що завершується виділенням CO2 та H2O [31]. В результаті цього відбувається виділення фрагментів ГК, що складаються також із вихідних мономерів у 200 кДа [30], які, у свою чергу, стимулюють розростання шкірних фібробластів та кератиноцитів [32]. Таким чином, ГК виділяється повільно, постійно збільшуючи гідратацію шкіри та забезпечуючи тривалий ефект біоревіталізації та концентрації. Крім того, ГК-ACP демонструє більш тривалий час утримання та кращу підтримку обсягу на відміну від аналогічної незшитої рецептури [33]. Таким чином, ГК-ACP рекомендується пацієнтам, які хочуть, щоб омолоджуючий ефект виглядав природнішим.
ГК-ACP довела свою ефективність в омолодженні обличчя у 22 пацієнтів, яким вдалося відновити значну еластичність та пружність шкіри [34]. Завдяки своїм омолоджуючим властивостям, ГК-ACP може також ефективно впоратися з омолодженням декольте. Однак існують анатомічні відмінності між обличчям та декольте [1-4], що вимагають прямого дослідження, яке дозволило б оцінити безпечне та ефективне використання в ділянці грудної клітки. Більше того, на думку авторів, нині немає жодних досліджень, що описують лікування декольте з використанням ГК-ACP. Відповідно, це проспективне експериментальне дослідження було спрямоване на дослідження ефективності та переносимості цієї рецептури для вищезгаданої мети.

(Таблиця 1) Оцінка за шкалою Біглі-Гібсон, як описано Холманом та співавторами [35]
(Таблиця 2) Оцінювання за шкалою Фабі-Болтона, як описано Фабі та співавторами [38]
Пацієнти та методи
Це було одноцентрове відкрите проспективне дослідження, ініційоване автором. Обстеження проводилося відповідно до Гельсінської декларації та Керівництва з належної клінічної практики. Усі пацієнти надали поінформовану згоду.
Критерії відбору: вік учасниць – від 30 до 65 років та оцінка за дерматоскопією за шкалою Біглі-Гібсона [35] (Таблиця 1) >2 та <5. Пацієнти також були повинні проходити всі навчальні процедури та подальші огляди та не мали права застосовувати іншу супутню естетичну процедуру в області декольте (таку як імплантація філера, ліфтинг, ін’єкція ботулінічного токсину, лазерна обробка або хімічний пілінг).
Були виключені учасники, які страждали на патологічні стани; які пройшли естетичне лікування в області декольте (наприклад, лазерну, пульсуючу світлову або біостимулюючу терапію) за 6 місяців до початку дослідження; сприйнятливі до розвитку атрофічних, гіпертрофічних або келоїдних рубців; які страждали на будь-яку місцеву хворобу шкіри (наприклад, інфекцією, дерматитом, дерматозом, псоріазом, екземою, розацеєю, герпесом); які проходили антикоагулянтну терапію протягом 10 днів з початку дослідження; які приймали аспірин або підвищену дозу вітаміну С протягом одного тижня з початку дослідження; були вагітними або планували вагітність; приймали будь-які досліджувані продукти протягом 30 днів з початку дослідження.
Базова оцінка
Під час набору (базовий етап) реєструвалися такі дані кожного учасника: вік, стать, історія хвороби та фототип шкіри за Фітцпатріком [36]. Учасників фотографували на одну камеру (EOS 600D, Canon, Токіо, Японія) при постійному освітленні, у положенні, коли плечі та руки покояться з боків тулуба. Пацієнти були класифіковані за шкалою Рубіна за фотостарінням [37] та шкалою Фабі-Болтона за ступенем зморшок у зоні декольте [38] (Таблиця 2).
Дерматоскопічне дослідження
З метою підвищення об’єктивності та точності оцінки пацієнти також були піддані дерматоскопічній експертизі (з використанням дерматоскопа HRMEDL7DM Dino Lite (Нарден, Нідерланди), оснащеного програмним забезпеченням Dino Capture 2.0). Дерматоскопічне дослідження зазвичай проводять для вивчення ураженої шкіри [39, 40], і тільки з недавніх пір його використовують для дослідження старіння шкіри [41, 42]. У цьому дослідженні дерматоскопія застосовувалася з метою підвищення об’єктивності та точності оцінки. Фотографії були отримані в масштабі 50х та 200х. Потім на зображеннях у масштабі 200х лінії на шкірі були оцінені за шкалою Біглі та Гібсона [35]. Оцінка завжди проводилася за трьома чітко визначеними A-C точками (Рис. 1), як описано Ванаманом та іншими, [43] з метою підвищення точності результатів проекту.
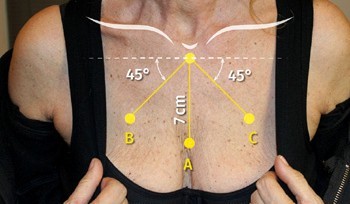
(Рис. 1) Три точки (А-С), які були оцінені за шкалою Біглі-Гібсона. Точка А розташована на 7 см нижче рукоятки грудини. Точки В і С розташовані нижче рукоятки на 7 см під кутом 45 градусів від лінії, яка перетинає рукоятку і розташована паралельно лінії плечей пацієнта.
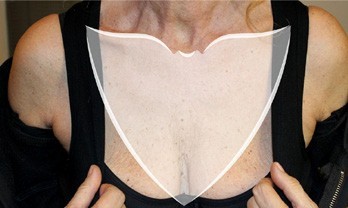
(Рис. 2) Зона лікування складається з грудної зони та двох третин середньої лінії ключиці.
Лікування та заключні результати
Учасники пройшли перший етап лікування у момент відбору, а потім через 21 та 42 дні. Під час кожного етапу лікування 2 мл ін’єкції ГК-ACР вводили з використанням методу мікропепарування шприцем під кутом 45 градусів, коли голку на 4 мм вводили в шкіру. точково приблизно на відстані 1-1,5 см малими порціями (близько 0,02 мл) [44]. Об’єм 2 мл дозволив покрити всю потрібну область, тобто площу, обмежену зоною грудей і двома третинами середньої лінії ключиці (Рис. 2).
Дослідження за шкалою Бейлі та Гібсона з дерматоскопії та фотографування проводилося повторно на останньому етапі лікування, а потім на 80-й та 120-й день з моменту базового етапу. Дерматоскопічна оцінка виставлялася за тими ж точками A-C, що були описані раніше. Фотографування проводилося за тих самих умов освітлення, які використовувалися під час попередніх етапів.
Під час останнього обстеження пацієнтів повторно оцінювали за шкалою Фабі-Болтона. На всіх етапах обстеження учасники та дослідники ставили оцінки задоволеності за шкалою від 0 до 10, де оцінка 0 – «немає результату» та 10 – «максимальний результат». Під час кожного етапу лікування та фінального обстеження контролювалися небажані реакції. Зокрема, дослідники оцінювали такі побічні реакції та інші, які не увійшли до списку: еритема, набряклість, почервоніння, біль, свербіж, синці та висип, і відзначали їх інтенсивність за шкалою від 1 до 4 балів (відсутні, у легкій формі, в помірній формі, у серйозній формі), а також період на вирішення проблеми. При будь-яких побічних реакціях реєструвалися їх тип, дата початку та закінчення, частота, інтенсивність, а також етап дослідження, під час якого було виявлено цей побічний ефект. Дослідник оцінював взаємозв’язок побічного ефекту з використанням ГК-ACР як достовірно, ймовірно, можливо, відсутність взаємозв’язку або невідомо.
Аналіз даних
Оскільки передбачалося, що це буде попереднім експериментальним дослідженням, що ґрунтується на об’єктивних дерматоскопічних спостереженнях, було довільно встановлено кількість у 15 учасників. На початковому етапі характеристики учасників підсумовувалися шляхом калькулюючої описової статистики за всіма зареєстрованими змінними (абсолютне або відносне значення для якісних змінних, а також способи, засоби, стандартні відхилення, мінімальні та максимальні інтервали для безперервних змінних). З метою дослідження дії даного лікування під час кожного обстеження зміни балів за шкалою Біглі-Гібсона порівняно з вихідними даними були досліджені з використанням тесту Вілкоксону для парних даних, скоригованих відповідно до корекції Бонферроні. Крім того, учасники були поділені на три групи («регрес», «без змін», «прогрес») відповідно до спостеріганого результату лікування порівняно з вихідними даними. Тест Вілкоксона для парних даних використовувався для дослідження змін в агрегації.
При дослідженні дії ГК-ACР у часі бали за шкалою Біглі-Гібсона на 80-й та 120-й контрольний день порівнювалися за допомогою тесту Вілкоксона для парних даних. Частоту виникнення несприятливих реакцій було охарактеризовано з допомогою описової статистики. Тривалість і час до вирішення кожної реакції оцінювалися шляхом обчислення їхнього середнього значення та відповідного стандартного відхилення. Оцінки для безперервних змінних у цьому дослідженні представлені як середнє ± стандартне відхилення. Статистичні тести вважалися значущими, якщо p < 0,05. Усі статистичні розрахунки було виконано з використанням стандартного статистичного програмного забезпечення (Origin 9.0, Origin Lab, Нортгемптон, США).
Результати
З квітня по травень 2015 року для участі у дослідженні було зареєстровано 15 учасниць, усі жінки. У вересні 2015 року було проведено останнє контрольне обстеження.
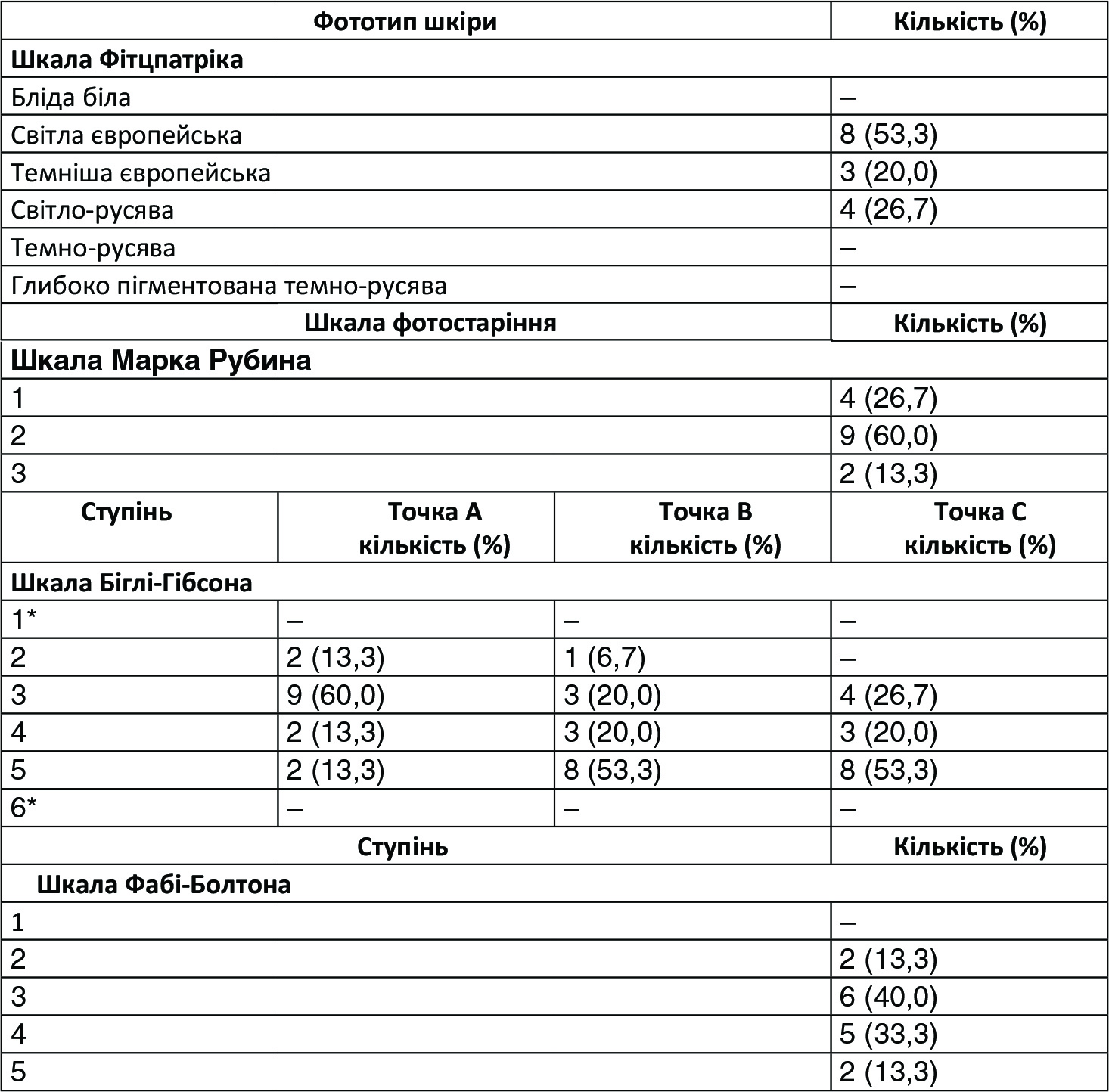
Середній вік учасників становив 49,0 ± 8,0 (діапазон 30-65). Десять учасників (66,7%) – курці. Класифікація пацієнтів згідно з фототипом за Фітцпатриком, фотостарінням за Рубіном, за шкалою Біглі-Гібсона та шкалою Фабі-Болтона на початковому рівні наведена в Таблиці 3. Усі контрольні обстеження виконувались чітко за запланованим графіком без порушень (Таблиця 4). Під час кожного етапу лікування усі пацієнти отримували ін’єкцію ГК по 2 мл.
(Таблиця 3) Характеристика учасників із моменту базового огляду.
* Пацієнти, які отримали 1 та 6 балів за шкалою Біглі-Гібсона, були виключені з дослідження
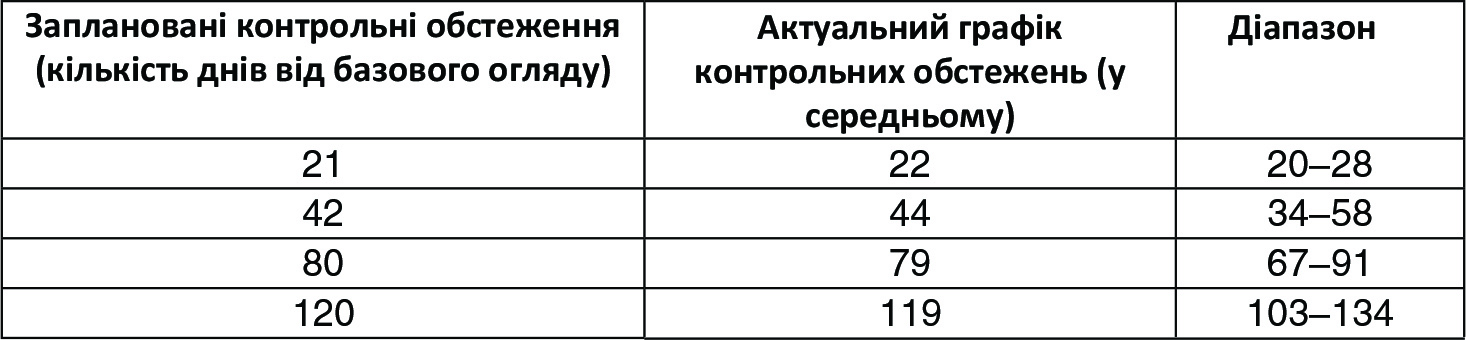
(Таблиця 4) Контрольні обстеження (запланований та актуальний графік).
Кількість пацієнтів, які показують високі бали за шкалою Біглі-Гібсона, поступово скорочувалася, як показано на Рис. 3, що свідчить про покращення естетичного зовнішнього вигляду пацієнтів. Спостерігалося значне поліпшення після третього етапу ін’єкції (p = 0,017) та на останньому контрольному обстеженні (p = 0,017) порівняно з результатами на базовому етапі. Фотографії декольте підтвердили покращення зовнішнього вигляду шкіри. (Рис. 4A); дерматоскопічне обстеження (Рис. 4B) показало, що при останній ін’єкції (день 42) первинні лінії мали однакову глибину і «зіркоподібну форму», відповідні 1-му класу за шкалою Біглі-Гібсона. Більше того, ці показники також спостерігалися під час контрольного обстеження. Коли учасники були класифіковані за результатами лікування, кількість пацієнтів у групі «прогрес» на 40-й, 80-й та 120-й день значно збільшилася порівняно з базовим рівнем (Рис. 5, р < 0,05 у всіх випадках).
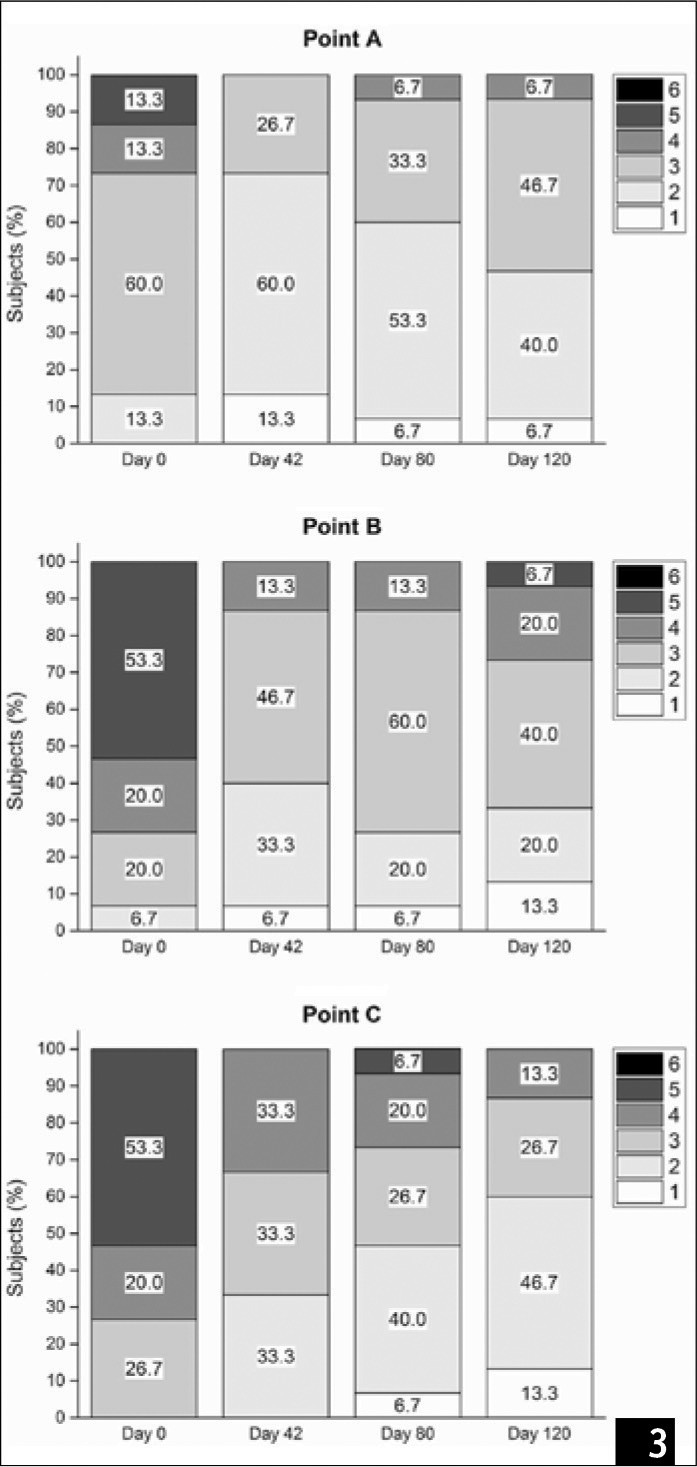
(Рис. 3) Розподіл учасників за шкалою Біглі-Гібсона у різні часові відрізки спостереження.
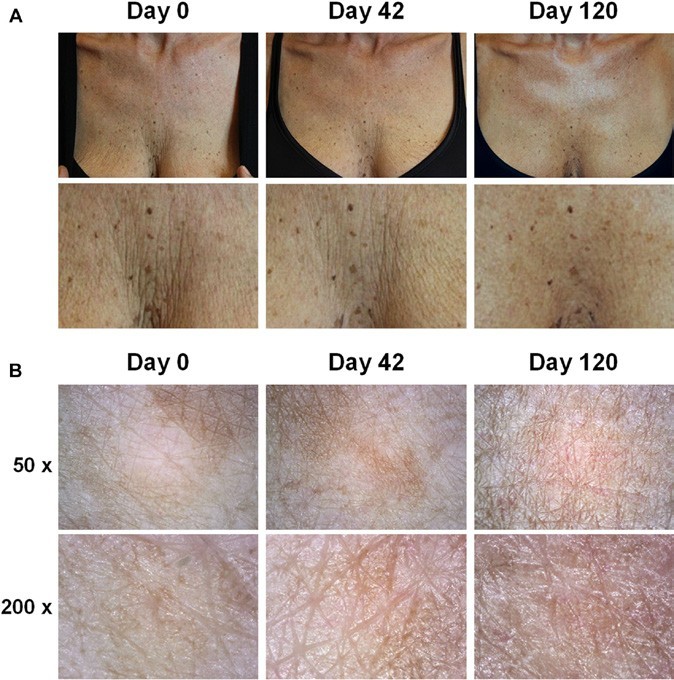
(рис 4) A. Приклад пацієнта на базовому рівні (день 0); під час останньої (третьої) ін’єкції (день 42); під час останнього обстеження (день 120). Омолоджуючий ефект після останньої ін’єкції суттєвий і зберігається з плином часу. На нижніх знімках збільшено зображення області грудної клітки, наведені вище. На фінальному контрольному обстеженні препарат відновив гідратацію та звів до мінімуму прояви млявості шкіри в ділянці грудної клітки, помітно відновив пружність та еластичність шкіри.
В. Зовнішній вигляд шкіри при дерматоскопічному обстеженні точки А на початку дослідження, після 42-го та 120-го днів дослідження. Результати для точок B та C (не показані) були схожі. При останній ін’єкції (день 42) первинні лінії мають ту ж глибину і «зіркоподібну форму», що відповідає оцінці 1 за шкалою Біглі-Гібсона. Ці характеристики все ще можна було спостерігати на останньому контрольному обстеженні.
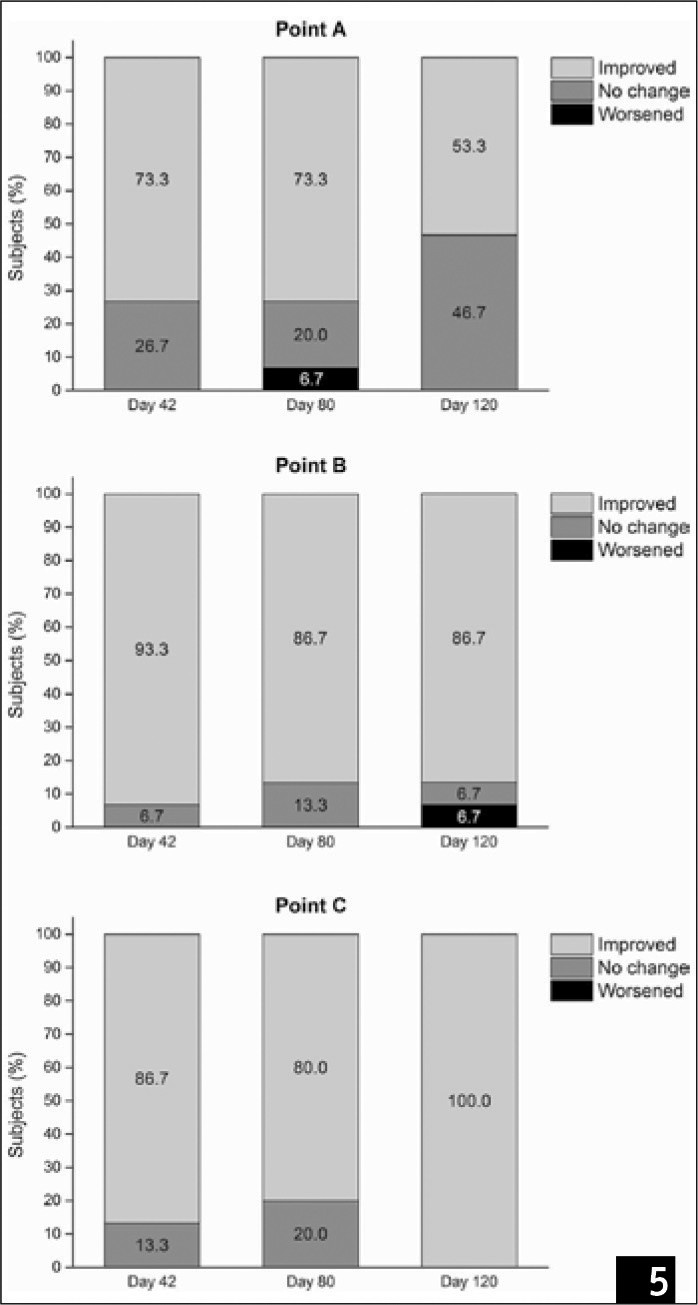
(Рис. 5) Розподіл учасників за групами «без змін», «регрес», «прогрес» згідно з балами, набраними за шкалою Біглі-Гібсона в різні часові відрізки порівняно з базовим рівнем.
Показання при обстеженні на 120-й день суттєво не відрізнялися від показань обстеження на 80-й день для всіх точок виміру (точка A, p = 0,48, точка B, p = 0,74, точка C, p = 0,08), що показує, що ефект лікування зберігається з плином часу.
Результати оцінювання за шкалою Фабі-Болтона показані на Рис. 6 та в Таблиці 5. У той час як більшість учасників на початковому етапі отримали оцінки 2 та 3, а 2 учасники (13,3%) отримали 4, на контрольному обстеженні (день 120-й) більшість пацієнтів набрали 1 та 2, і ніхто не отримав оцінку 4 (Рис. 6). Зміна оцінок за шкалою Фабі-Болтона між двома тимчасовими відрізками була значною (p < 0,05) (Таблиця 5), що вказує на суттєвий прогрес учасників з плином часу.
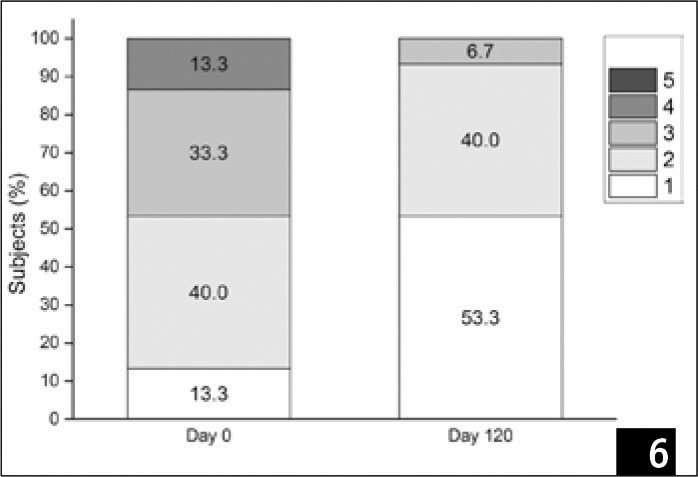
(Рис. 6) Розподіл учасників за набраними балами за шкалою Фабі-Болтона на базовому рівні та на 120-й день.
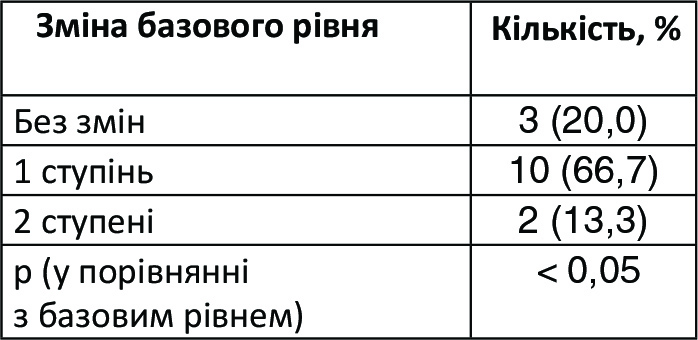
(Таблиця 5) Розподіл учасників згідно зі змінами набраних балів за шкалою Фабі-Болтона на 120-й день порівняно з базовим рівнем.
Суб’єктивні оцінки учасників та дослідників щодо переваг лікування в основному були задовільними (≥6) протягом усього лікування та під час контрольних обстежень (Рис. 7). Загалом, учасники поставили вищі бали, ніж дослідники: найнижчий бал, який був поставлений учасниками, (два випадки), становив 7, тоді як найнижчий бал, поставлений дослідниками, становив 6 (чотири випадки). На контрольному обстеженні (120-й день спостереження) пацієнти та дослідники виставили суб’єктивну оцінку між 8 та 10 у 93,3% та 80% випадків відповідно (Рис. 7).
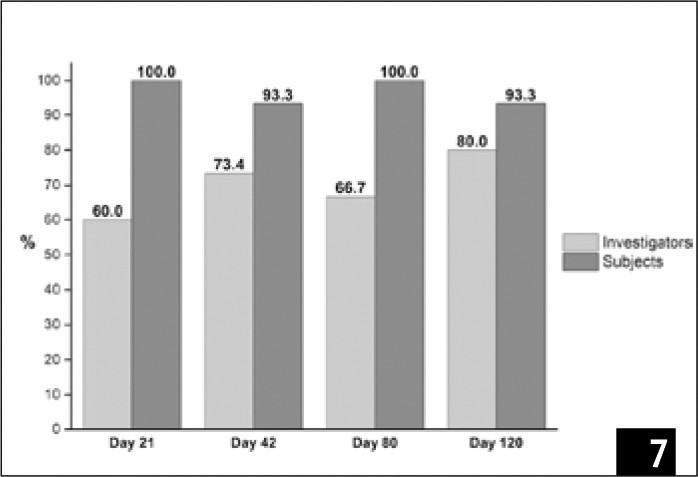
(Рис. 7) Відсоткове співвідношення випадків, які отримали оцінку від 8 до 10 відповідно до суб’єктивного сприйняття результату (0 – немає результату; 10 – максимальний результат) двома дослідниками (світло-сірим) та 15 учасницями (темно-сірим) протягом різних часових відрізків.
Що стосується безпеки, у 11 учасників були виявлені синці (73,3%), які зберігалися в середньому 5,9 ± 1,0 днів. Почервоніння спостерігалося у 8 учасників (53,3%), середня тривалість 9,1 ± 6,9 годин. Один пацієнт (6,7%) скаржився на помірні пухирі після першої ін’єкції. Усі небажані реакції були визначені та вирішені у розумний термін.
Обговорення результатів
Результати цього дослідження показують, що досліджувана рецептура ГК може забезпечити суттєве постійне та об’єктивне скорочення зморшок у ділянці декольте протягом 120 днів після першої ін’єкції. Завдяки характеру та ступеню поперечного зв’язку ГК-ACР, якому властиве поступове виділення з плином часу, забезпечуючи зволожуючу та омолоджуючу дію, а також завдяки природним властивостям зволоження та в’язкопружності природного полімеру, еластичність та пружність шкіри підвищується на тривалий період [45].
Крім того, підвищення тиску за рахунок регідратації ГК може викликати реактивацію фібробластів та виготовлення [30], що може стимулювати різке збільшення кількості фібробластів і кератиноцитів [32]. За спостереженнями цього дослідження, всі перераховані вище механізми призводять до суттєвого відновлення еластичності та пружності шкіри.
ГК-ACР вже довела свою безпеку та ефективність при лікуванні старіння обличчя [34]. Результати цього дослідження показують, що ГК-ACР також має суттєву омолоджуючу дію, а також повертає пружність шкіри в зоні грудної клітки, яка в силу своїх анатомічних характеристик [1-4] є однією з найскладніших зон для лікувальних омолоджувальних процедур в цілому та на основі ін’єкційних препаратів ГК [43].
Говорячи про омолоджуюче лікування, основною метою лікарів і пацієнтів є ефективне поліпшення естетичного стану. Що стосується естетичної користі від лікування ГК-ACР, суб’єктивні оцінки пацієнтів та дослідників були дуже високі.
Більше того, препарат ГК-ACР був ретельно розроблений та його використання є повністю безпечним. Побічні ефекти виявлялися у формі легких синців та почервонінь, що є нормальною реакцією після лікування із застосуванням внутрішньошкірних ін’єкцій. Тривалість цих проявів була в межах норми для такого виду лікування [47], також не спостерігалися будь-які вузлові утворення у місцях введення ін’єкції ні під час цього дослідження, ні в інших випадках, коли автори використовували ГКACР у своїй клінічній практиці. Відсутність появи стороннього тіла або інших серйозних реакцій може бути пов’язана з посиленими показниками безпеки ГК-ACР. Будучи автоматично (не хімічно) зшитою, вона викликає менше подразнення, чутливості чи реакції стороннього тіла. Також грудна клітка не схильна до ускладнень, що виникають через закупорення судин, до яких схильне обличчя [48]. ГК не є зшитою хімічно, що сприяє безпосередньому її розщепленню. Це може додатково знизити можливість прояву небажаних побічних ефектів після ін’єкції. Однак гіалуронідаза завжди повинна бути під рукою при введенні ін’єкційних внутрішньошкірних препаратів на основі ГК. Пацієнти, які взяли участь у цьому дослідженні, також повідомили, що не відчували больових симптомів як під час ін’єкції, так і після неї. Жодних інфекцій або серйозних побічних ефектів не було зареєстровано, і жоден пацієнт не припинив лікування через несприятливу реакцію.
Недоліками цього дослідження є невелика кількість пацієнтів та відсутність контрольної групи, яка була б оброблена іншими препаратами на основі ГК із більш довгою історією використання для омолодження декольте. Як і у випадку інших методів омолодження, ефект біоревіталізації, який може бути отриманий після ГК-ACР, не вважається однозначним; проте поки що бракує тривалого спостереження щодо збереження ефекту після застосування ГК-ACР. Для підтвердження результатів цього проспективного експериментального дослідження надалі необхідно проведення проспективних досліджень за участю більшої кількості пацієнтів та протягом більш тривалого періоду спостереження, а також за участю належної контрольної групи.
Висновки
ГК-ACР – омолоджуючий ін’єкційний медичний препарат, який досліджується у цій статті, є безпечним, добре переносимим, забезпечує довготривалу омолоджуючу дію та є ефективним засобом для розгладження зморшок в області декольте. Для підтвердження отриманих результатів подальші проспективні контрольні дослідження лікування старіння повинні проводитися за участю більшої кількості пацієнтів та у порівнянні з іншими «зшитими» препаратами на основі ГК.
Конфлікт інтересів. Автори заявляють, що не мають конфліктів інтересів щодо розголошення інформації.
Література
- Peterson J. D., Goldman M. P. Rejuvenation of the aging chest: a review and our experience. Dermatol Surg. 2011; 37: p. 555-571.
- Peterson J. D., Kilmer S. L. ThreeDimensional Rejuvenation of the Decolletage. Dermatol Surg. 2016; 42 (Suppl 2): p. S101-S107.
- Mazzuco R., Hexsel D. Poly-L-lactic acid for neck and chest rejuvenation. Dermatol Surg. 2009; 35: p. 1228-1237.
- Otberg N., Richter H., Schaefer H., Blume-Peytavi U., Sterry W., Lademann J. Variations of hair follicle size and distribution in different body sites. J. Invest Dermatol. 2004; 122 (1): p. 14-19.
- Hwang K., Kim J. Y., Lim J. H. Anatomy of the platysma muscle. J. Craniofac Surg. 2017; 28 (2): p. 539-542.
- Becker-Wegerich P. M., Rauch L., Ruzicka T. Botulinum toxin A: successful decollete rejuvenation. Dermatol Surg. 2002; 28 (2): p. 168-171.
- Wlaschek M., Tantcheva-Poor I., Naderi L., Ma W., Schneider L. A., Razi-Wolf Z., Schuller J., ScharffetterKochanek K. Solar uv irradiation and dermal photoaging. J. Photochem Photobiol. 2001; B 63: p. 41-51.
- Kammeyer A., Luiten R. M. Oxidation events and skin aging. Ageing Res Rev. 2015; 21: p. 16-29.
- Yaar M., Eller M. S., Gilchrest B. A. Fifty years of skin aging. J. Investig Dermatol Symp Proc. 2002; 7 (1): p. 51-58.
- Rittie L., Fisher G. J. Natural and suninduced aging of human skin. Cold Spring Harb Perspect Med. 2015; 5 (1): p. a015370.
- Quan T., Fisher G. J. Role of ageassociated alterations of the dermal extracellular matrix microenvironment in human skin aging: a mini-review. Gerontology. 2015; 61 (5): p. 427-434.
- Sherratt M. J. Age-related tissue stiffening: cause and effect. Adv Wound Care (New Rochelle). 2013; 2 (1): p. 11-17.
- Kurban R. S., Bhawan J. Histologic changes in skin associated with aging.
- Dermatol Surg Oncol. 1990 16 (10): p. 908-914.
- El-Domyati M., Attia S., Saleh F., Brown D., Birk D. E., Gasparro F., Ahmad H., Uitto J. Intrinsic aging vs. photoaging: a comparative histopathological, immunohistochemical, and ultrastructural study of skin. Exp Dermatol. 2002; 11 (5): p. 398-405
- Gniadecka M., Nielsen O. F., Wessel S., Heidenheim M., Christensen D. H., Wulf
- C. Water and protein structure in photoaged and chronically aged skin. J. Invest Dermatol. 1998; 111 (6): p. 1129-1133.
- Lee D. H., Oh J. H., Chung J. H. Glycosaminoglycan and proteoglycan in skin aging. J. Dermatol Sci. 2016; 83 (3): p. 174-181.
- Oh J. H., Kim Y. K., Jung J. Y., Shin
- E., Kim K. H., Cho K. H., Eun H. C., Chung J. H. Intrinsic agingand photoaging-dependent level changes of glycosaminoglycans and their correlation with water content in human skin. J. Dermatol Sci. 2011; 62 (3): p. 192-201.
- Tzellos T. G., Klagas I., Vahtsevanos K., Triaridis S., Printza A., Kyrgidis A., Karakiulakis G., Zouboulis C. C., Papakonstantinou E. Extrinsic ageing in the human skin is associated with alterations in the expression of hyaluronic acid and its metabolizing enzymes. Exp Dermatol. 2009; 18 (12): p. 1028-1035.
- Fraser J. R., Laurent T. C., Laurent
- B. Hyaluronan: its nature, distribution, functions and turnover. J. Int Med. 1997; 242 (1): p. 27-33.
- Cowman M. K., Matsuoka S. Experimental approaches to hyaluronan structure. Carbohydr Res. 2005; 340 (5): p. 791-809.
- Dea I. C., Moorhouse R., Rees
- A., Arnott S., Guss J. M., Balazs E. A. Hyaluronic acid: a novel, double helical molecule. Science. 1973; 179 (4073): p. 560-562.
- Tezel A., Fredrickson G. H. The science of hyaluronic acid dermal fillers.
- Cosmet Laser Ther. 2008; 10 (1): p. 35-42. Erratum in: J. Cosmet Laser Ther. 2014; 16 (1): p. 45.
- Matarasso S. L. Understanding and using hyaluronic acid. Aesthet Surg J. 2004; 24 (4): p. 361-364.
- Collins M. N., Birkinshaw C. Physical properties of crosslinked hyaluronic acid hydrogels. J. Mater Sci Mater Med. 2008; 19 (11): p. 3335-3343.
- Highley C. B., Prestwich G. D., Burdick J. A. Recent advances in hyaluronic acid hydrogels for biomedical applications. Curr Opin Biotechnol. 2016; 40: p. 35-40.
- Beasley K. L., Weiss M. A., Weiss R. A. Hyaluronic acid fillers: a comprehensive review. Facial Plast Surg. 2009; 25 (2): p. 86-94.
- Greene J. J., Sidle D. M. The hyaluronic acid fillers: current understanding of the tissue device interface. Facial Plast Surg Clin North Am. 2015; 23 (4): p. 423-432.
- Sparavigna A., Fino P., Tenconi B., Giordan N., Amorosi V., Scuderi N. A new dermal filler made of cross-linked and auto-cross-linked hyaluronic acid in the correction of facial aging defects. J. Cosmet Dermatol. 2014; 13 (4): p. 307-314.
- Alessandrini A., Fino P., Giordan N., Amorosi V., Scuderi N. Evaluation of a new hyaluronic acid dermal filler for volume restoration. J. Cosmet Laser Ther . 2015; 17 (6): p. 335-342.
- Pluda S., Pavan M., Galesso D., Guarise C. Hyaluronic acid auto-crosslinked polymer (ACP): reaction monitoring, process investigation and hyaluronidase stability. Carbohydr Res. 2016; 433: p. 47-53.
- Renier D., Bellato P., Bellini D., Pavesio A., Pressato D., Borrione A. Pharmacokinetic behaviour of ACP gel, an autocrosslinked hyaluronan derivative, after intraperitoneal administration. Biomaterials. 2005; 26 (26): p. 5368-5374.
- Wohlrab J., Wohlrab D., Neubert R. H. Comparison of noncrosslinked and cross-linked hyaluronic acid with regard to efficacy of the proliferative activity of cutaneous fibroblasts and keratinocytes in vitro. J. Cosmet Dermatol. 2013; 12 (1): p. 36-40.
- Alessandrini A., Di Bartolo C., Pavesio A., Pressato D. ACP gel: a new hyaluronic acid-based injectable for facial rejuvenation. Preclinical data in a rabbit model. Plast Reconstr Surg. 2006 ; 118 (2): p. 341-346.
- Di Pietro A., Colomba D. M., Giordan N. Facial wrinkles correction and skin rejuvenation (biostimulation) by auto-crosslinked hyaluronic acid. J. Plast Dermatol. 2007; 3: p. 2-5.
- Holman C. D., Armstrong B. K., Evans P. R., Lumsden G. J., Dallimore K. J., Meehan C. J., Beagley J., Gibson I. M. Relationship of solar keratosis and history of skin cancer to objective measures of actinic skin damage. Br J. Dermatol. 1984; 110 (2): p. 129-138.
- Fitzpatrick T. B. The validity and practicality of sun-reactive skin types I through VI. Arch Dermatol. 1988; 124 (6): p. 869-871.
- Rubin M. Manual of chemical peels: superficial and medium depth. Lippincott & Williams, Philadelphia. 1995.
- Fabi S., Bolton J., Goldman M. P., Guiha I. The Fabi-Bolton chest wrinkle scale: a pilot validation study. J. Cosmet Dermatol. 2012; 11 (3): p. 229-234.
- Russo T., Piccolo V., Lallas A., Argenziano G. Recent advances in dermoscopy. F1000Res. 2016; 5. pii: F1000 Faculty Rev 184
- Lallas A., Giacomel J., Argenziano G., Garca-Garca B., Gonzalez-Fernandez D., Zalaudek I., Vazquez-Lopez F. Dermoscopy in general dermatology: practical tips for the clinician. Br J. Dermatol. 2014; 170 (3): p. 514-526.
- Choi Y. H., Kim D., Hwang E., Kim B. J. Skin texture aging trend analysis using dermoscopy images. Skin Res Technol. 2014; 20 (4): p. 486-497.
- Isik B., Gurel M. S., Erdemir A. T., Kesmezacar O. Development of skin aging scale by using dermoscopy. Skin Res Technol. 2013; 19 (2): p. 69-74.
- Vanaman M., Fabi S. G. Decolletage: regional approaches with injectable fillers. Plast Reconstr Surg. 2015; 136 (5 Suppl): p. 276S-281S.
- Kerscher M., Bayrhammer J., Reuther T. Rejuvenating influence of a stabilized hyaluronic acid-based gel of nonanimal origin on facial skin aging. Dermatol Surg. 2008; 34 (5): p. 720-726.
- Kablik J., Monheit G. D., Yu L., Chang G., Gershkovich J. Comparative physical properties of hyaluronic acid dermal fillers. Dermatol Surg. 2009; 35 (Suppl 1): p. 302-312.
- Wang F., Garza L. A., Kang S., Varani J., Orringer J. S., Fisher G. J., Voorhees J. J. In vivo stimulation of de novo collagen production caused by cross-linked hyaluronic acid dermal filler injections in photodamaged human skin. Arch Dermatol. 2007; 143 (2): p. 155-163.
- Chiang Y. Z., Pierone G., AlNiaimi F. Dermal fillers: pathophysiology, prevention and treatment of complications. J. Eur Acad Dermatol Venereol. 2017; 31 (3): p. 405-413.
- Salval A., Ciancio F., Margara A., Bonomi S. Impending facial skin necrosis and ocular involvement after dermal filler injection: a case report. Aesthetic Plast Surg. 2017 May 31. [Epub ahead of print].
