Базовая проблематика. В качестве лечения для омоложения кожи была предложена новая рецептура гиалуроновой кислоты по технологии auto-cross-link с поперечной межмолекулярной связью (ГК-ACP). Цель этого проспективного пилотного исследования – изучить ее переносимость и эффективность при лечении старения кожи в области декольте.
Андреа Алессандрини, доктор эстетической медицины, специалист по сосудистой хирургии, профессор Римского университета La Sapienza, руководитель отдела ангиологии Министерства здравоохранения Италии, тренер компании Phitogen Holding (Италия)

Методы. В исследовании принимали участие пятнадцать женщин (среднего возраста 49,0 ± 8,0 (диапазон 30-65)), которые жаловались на состояние кожи в области декольте. Им был проведен курс из трех процедур внутрикожных инъекций ГК-ACP (IAL-SYSTEM ACP) – каждый с интервалом в три недели. Контрольные обследования проводились через 80 и 120 дней с момента регистрации. Эффект омоложения оценивали по шкале Бигли-Гибсона и Фэби-Болтона. Исследователи и пациенты также субъективно оценивали внешний вид кожи по десятибалльной шкале.
Омолаживающий эффект и его переносимость оценивались путем сопоставления баллов, собранных в разные контрольные отрезки времени, с помощью ранговых критериев Уилкоксона. Побочные эффекты и их продолжительность были зарегистрированы и сравнены с данными, указанными в литературе.
Результаты. Рецептура ГК-ACP обеспечивала значительное улучшение по шкале Бигли-Гибсона (p <0,005) во все контрольные отрезки времени. Во время обследования на 120-й день исследования показатель ФабиБолтона был значительно улучшен по сравнению с исходным уровнем (p < 0,05).
Омолаживающий эффект сохранялся между контрольными обследованиями на 80-й и 120-й дни. Во время наблюдения на 120й день субъективные оценки исследователей и пациентов составляли от 8 до 10 баллов. Непредвиденные побочные эффекты не наблюдались. Все побочные эффекты хорошо переносились участниками и проходили в течение короткого периода времени.
Выводы. Лечение рецептурой ГК-ACP под наблюдением является безопасным, хорошо переносимым и обеспечивает эффективное и продолжительное омоложение зоны декольте.
Введение
Признаки старения особенно заметны в области декольте, и спрос на омоложение груди растет [1, 2]. Эпидермис и дерма в области декольте тоньше, чем в других областях, таких как лицо [1, 3], подкожной жировой ткани и сальных желез меньше [2, 4]. Кроме того, декольте постоянно подвергается действию мышцы платизма [5], что приводит к образованию морщин в области шеи, а также в средней и глубокой грудной клетке [6]. Эти факторы влияют на старение кожи в области декольте [7] и делают ее омоложение сложным в части переносимости и эффективности.
Старение кожи вызвано двумя факторами: интервалом времени (внутреннее старение) и изменениями от солнечного воздействия (внешнее старение) [8, 9]. Внутреннее старение, вызванное клеточным старением, приводит к сглаживанию дермо-эпидермального соединения (DEJ) и уменьшению толщины дермы. Внутренне постаревшая кожа характеризуется сухостью, тонкостью и поздним появлением мелких морщин [2]. Напротив, внешне постаревшая кожа характеризуется быстрой деградацией и изменением экстрацеллюлярной матрицы (ECM), вызванной активацией металлопротеинов (MMP) и повышенной стимуляцией от воздействия ультрафиолетовых лучей. Как следствие, кожа от фотостарения становится грубой, рыхлой и морщинистой [10, 11]. Эти два процесса являются накопительными и приводят к значительным изменениям структуры и плотности коллагена, гликозакоминогликанов (GAG) и эластичных волокон в папиллярной и ретикулярной дерме [12-14]. Вследствие старения кожа теряет свою способность удерживать влагу с течением времени, становится грубее и менее упругой [15]. Помимо воздействия на гликозакоминогликаны (GAG), процесс старения существенно усиливает биосинтез гиалуроновой кислоты (ГК) [16-18].
ГК представляет собой полисахарид, состоящий из повторяющихся звеньев дисахаридов D-глюкуроновой кислоты и N-ацетил D-глюкозамина, что в экстрацеллюлярной матрице ЭЦМ соединительных тканей связывается с протеогликанами, фибронектином и коллагеном. ГК поддерживает объем и водный баланс кожи [19]. ГК обладает мощным гидрофильным свойством [20], растворяется в воде для образования вязких гелей [21, 22]. Поэтому ГК часто используется как инъекционный состав для восстановления упругости кожи, а также корректирования морщин и складок кожи [22]. ГК может подвергаться определенной степени поперечного сшивания [23] с целью смягчения ее реологических и водоудерживающих свойств, а также повышения време ни ее деградации [22]. Характер реагентов, используемых для поперечной сшивки ГК, степени сшивания и тип межи внутримолекулярных связей, которые могут быть созданы, очень различны [24, 25], а «оптимальная» степень сшивания еще не определена [26]. Соответственно, устойчивость, переносимость и общий потенциал различных сшитых формул должны оцениваться в каждом конкретном случае [27].
Недавно был предложен ряд рецептур на основе ГК (IAL-System, Fidia, Абано-Терме, Италия) для омоложения морщин, начиная от мелких до глубоких, требующих постоянного увеличения объема [28, 29]. Одна из таких рецептур (IAL-System ACP, в дальнейшем сокращенно как ГК-ACP) содержит ГК, которая подвергается реакции автосшивания для создания межи внутримолекулярных связей между мономерами ГК [30, 31]. Будучи автоматически сшитой, ГК-ACP не содержит остаточных химических веществ и подвергается медленному распаду, что повышает показатели ее безопасности.
Было показано, что ГК-ACP катаболизируется через физиологический путь распада ГК, завершающийся выделением CO2 и H2O [31]. В результате этого происходит выделение фрагментов ГК, состоящих также из исходных мономеров в 200 кДа [30], которые, в свою очередь, стимулируют разрастание кожных фибробластов и кератиноцитов [32]. Таким образом, ГК выделяется медленно, постоянно увеличивая гидратацию кожи и обеспечивая длительный эффект биоревитализации и концентрации. Кроме того, ГК-ACP демонстрирует более длительное время удержания и лучшее поддержание объема в отличие от аналогичной несшитой рецептуры [33]. Таким образом, ГК-ACP рекомендуется пациентам, которые хотят, чтобы омолаживающий эффект казался более естественным.
ГК-ACP доказала свою эффективность в омоложении лица у 22 пациентов, которым удалось восстановить значительную эластичность и упругость кожи [34]. Благодаря своим омолаживающим свойствам, ГК-ACP может также эффективно справиться с омоложением декольте. Тем не менее, существуют анатомические различия между лицом и декольте [1-4], требующие прямого исследования, позволяющего оценить безопасное и эффективное использование в области грудной клетки. Более того, по мнению авторов, в настоящее время не существует никаких исследований, описывающих лечение декольте с использованием ГК-ACP. Соответственно, настоящее проспективное экспериментальное исследование было направлено на исследование эффективности и переносимости этой рецептуры для вышеуказанной цели.

(Таблица 1) Оценка по шкале Бигли-Гибсон, как описано Холманом и соавторами [35]

(Таблица 2) Оценивание по шкале Фаби-Болтона, как описано Фаби и соавторами [38]
Пациенты и методы
Это было одноцентровое откры тое проспективное исследование, инициированное автором. Обследование проводилось в соответствии с Хельсинкской декларацией и Руководством по надлежащей клинической практике. Все пациенты предоставили информированное согласие.
Критерии отбора: возраст участниц – от 30 до 65 лет и оценка по дерматоскопии по шкале Бигли-Гибсона [35] (таблица 1) > 2 и < 5. Пациенты также должны были проходить все учебные процедуры и последующие осмотры и не имели право применять другую сопутствующую эстетическую процедуру в области декольте (например, имплантация филлера, лифтинг, инъекция ботулинического токсина, лазерная обработка или химический пилинг).
Были исключены участники, страдающие патологическими состояниями; прошедшие эстетическое лечение в области декольте (например, лазерную, пульсирующую световую или биостимулирующую терапии) за 6 месяцев до начала исследования; восприимчивые к развитию атрофических, гипертрофических или келоидных рубцов; страдающие любой местной болезнью кожи (например, инфекцией, дерматитом, дерматозом, псориазом, экземой, розацеа, герпесом); проходившие антикоагулянтную терапию в течение 10 дней с момента начала исследования; принимавшие аспирин или повышенную дозу витамина С в течение одной недели с момента начала исследования; были в положении или планировали беременность; принимали любые исследуемые продукты в течение 30 дней с момента начала исследования.
Базовая оценка
Во время набора (базовый этап) регистрировались следующие данные каждого участника: возраст, пол, история болезни и фототип кожи по Фитцпатрику [36]. Участников фотографировали на одну камеру (EOS 600D, Canon, Токио, Япония) при постоянном освещении, в положении, когда плечи и руки покоятся по бокам туловища. Пациенты были классифицированы по шкале Рубина по фотостарению [37] и шкале Фаби-Болтона по степени морщин в зоне декольте [38] (таблица 2).
Дерматоскопическое исследование
С целью повышения объективности и точности оценки пациентов также подвергли дерматоскопической экспертизе (с использованием дерматоскопа HRMEDL7DM Dino Lite (Нарден, Нидерланды), оснащенного программным обеспечением Dino Capture 2.0). Дерматоскопическое исследование обычно проводят для изучения пораженной кожи [39, 40], и только с недавних пор его рассматривают для исследования старения кожи [41, 42]. В настоящем исследовании дерматоскопия применялась с целью повышения объективности и точности оценки. Фотографии были получены в масштабе 50х и 200х. Затем на изображениях в масштабе 200х линии на коже были оценены по шкале Бигли и Гибсона [35]. Оценка всегда проводилась по трем четко определенным A-C точкам (рис. 1), как описано Ванаманом и другими, [43] с целью повышения точности результатов проекта.
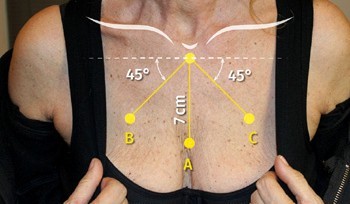
(Рис. 1) Три точки (А-С), которые были оценены по шкале Бигли-Гибсона. Точка А расположена на 7 см ниже рукоятки грудины. Точки В и С расположены ниже рукоятки на 7 см под углом 45 градусов от линии, которая пересекает рукоятку и расположена параллельно линии плеч пациента.
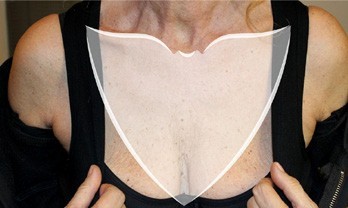
(Рис. 2) Зона лечения состоит из грудной зоны и двух третей средней линии ключицы.
Лечение и заключительные результаты
Участники прошли первый этап лечения в момент отбора, а затем через 21 и 42 дня. Во время каждого этапа лечения 2 мл инъекции ГК-ACР вводили с использованием метода микропрепаровки шприцом под углом 45 градусов, когда иглу на 4 мм вводили в кожу точечно приблизительно на расстоянии 1-1,5 см малыми порциями (около 0,02 мл) [44]. Объем 2 мл позволил покрыть всю интересующую область, то есть площадь, ограниченную зоной груди и двумя третями средней линии ключицы (рис. 2).
Исследование по шкале Бэйли и Гибсона по дерматоскопии и фотографированию проводилось повторно на последнем этапе лечения, а затем на 80-й и 120-й день с момента базового этапа. Дерматоскопическую оценку выставляли по тем же A-C точкам, которые были описаны ранее. Фотографирование проводилось при тех же условиях освещения, которые использовались во время предыдущих этапов.
Во время последнего контрольного обследования пациентов повторно оценивали по шкале Фаби-Болтона. На всех этапах обследования участники и исследователи ставили оценки удовлетворенности по шкале от 0 до 10, где оценка 0 – «нет результата» и 10 – «максимальный результат». Во время каждого этапа лечения и финального обследования контролировались нежелательные реакции. В частности, исследователи оценивали следующие побочные реакции и другие, не вошедшие в список: эритема, отечность, покраснение, боль, зуд, синяки и сыпь, и отмечали их интенсивность по шкале от 1 до 4 баллов (отсутствуют, в легкой форме, в умеренной форме, в серьезной форме), а также период на решение проблемы. При любых побочных реакциях регистрировались их тип, дата начала и окончания, частота, интенсивность, а также этап исследования, во время которого был выявлен данный побочный эффект. Исследователь оценивал взаимосвязь побочного эффекта с использованием ГК-ACР как достоверно, вероятно, возможно, отсутствие взаимосвязи или неизвестно.
Анализ данных
Поскольку предполагалось, что это будет предварительным экспериментальным исследованием, основанным на объективных дерматоскопических наблюдениях, было произвольно установлено количество в 15 участников. На исходном этапе характеристики участников суммировались путем калькулирующей описательной статистики по всем зарегистрированным переменным (абсолютное или относительное значение для качественных переменных, а также способы, средства, стандартные отклонения, минимальные и максимальные интервалы для непрерывных переменных). С целью исследования действия данного лечения во время каждого обследования изменения баллов по шкале Бигли-Гибсона, по сравнению с исходными данными, были исследованы с использованием теста Вилкоксона для парных данных, скорректированных в соответствии с коррекцией Бонферрони. Кроме того, участники были разделены на три группы («регресс», «без изменений», «прогресс») в соответствии с наблюдаемым результатом лечения по сравнению с исходными данными. Тест Вилкоксона для парных данных использовался для исследования изменений в агрегации.
При исследовании действия ГК-ACР во времени баллы по шкале БиглиГибсона на 80-й и 120-й контрольный день сравнивались с помощью те ста Вилкоксона для парных данных. Частота возникновения неблагоприятных реакций была охарактеризована с помощью описательной статистики. Длительность и время до разрешения каждой реакции оценивались путем вычисления их среднего значения и соответствующего стандартного отклонения. Оценки для непрерывных переменных в настоящем исследовании представлены как среднее ± стандартное отклонение. Статистические тесты считались значимыми, если p < 0,05. Все статистические расчеты были выполнены с использованием стандартного статистического программного обеспечения (Ориджин 9.0, Ориджин Лэб, Нортгемптон, США).
Результаты
С апреля по май 2015 года для участия в исследовании было зарегистрировано 15 участниц, все женщины. В сентябре 2015 года было проведено последнее контрольное обследование.
Средний возраст участников соста вил 49,0 ± 8,0 (диапазон 30-65). Десять участников (66,7%) – курящие. Классификация пациентов согласно фототипу по Фитцпатрику, фотостарению по Рубину, по шкале Бигли-Гибсона и шкале Фаби-Болтона на исходном уровне приведена в таблице 3. Все контрольные обследования выполнялись четко по запланированному графику без нарушений (таблица 4). Во время каждого этапа лечения все пациенты получали инъекцию ГК по 2 мл.
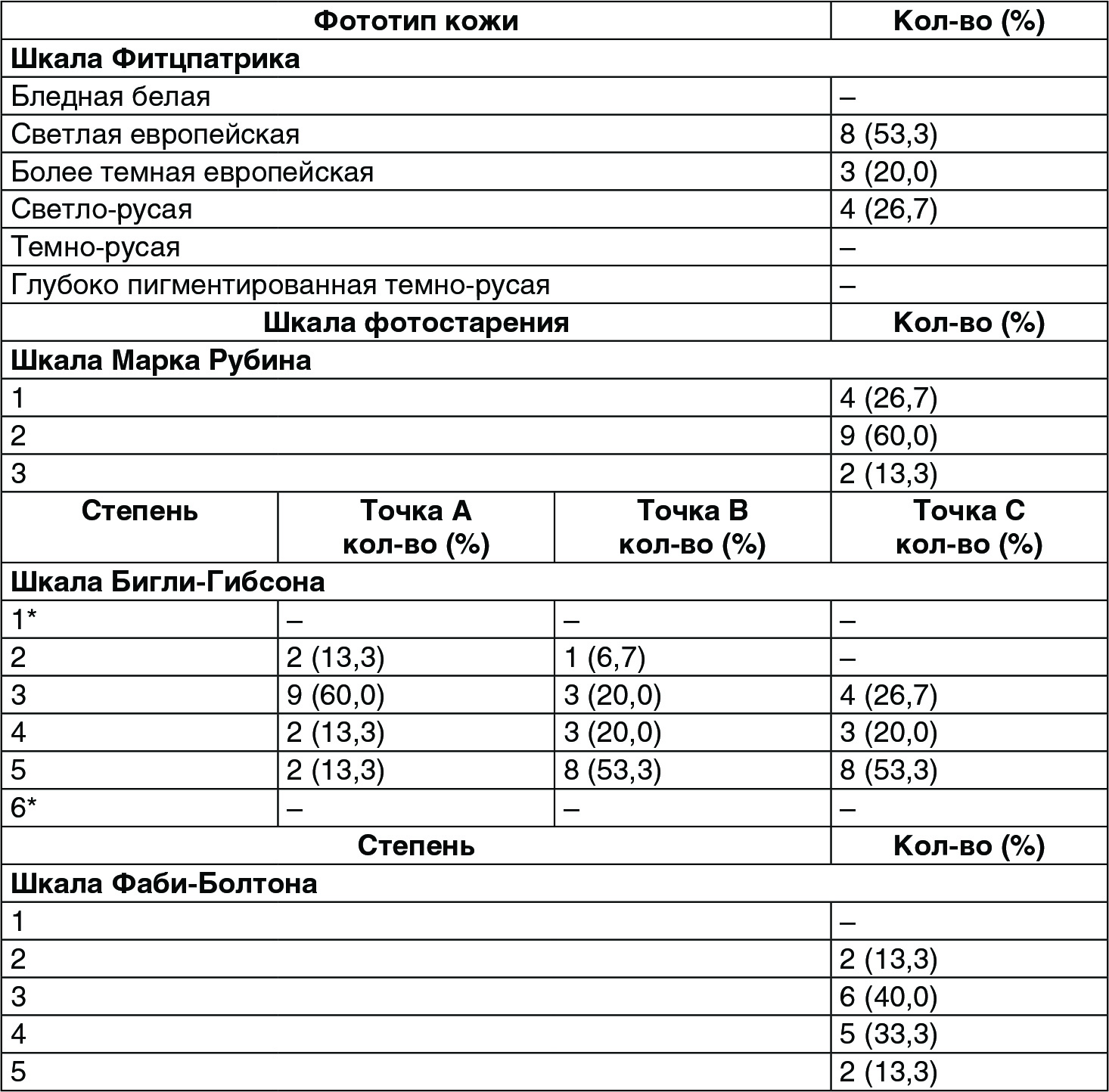
(Таблица 3) Характеристика участников с момента базового осмотра.
*Пациенты, получившие 1 и 6 баллов по шкале Бигли-Гибсона, были исключены из исследования.
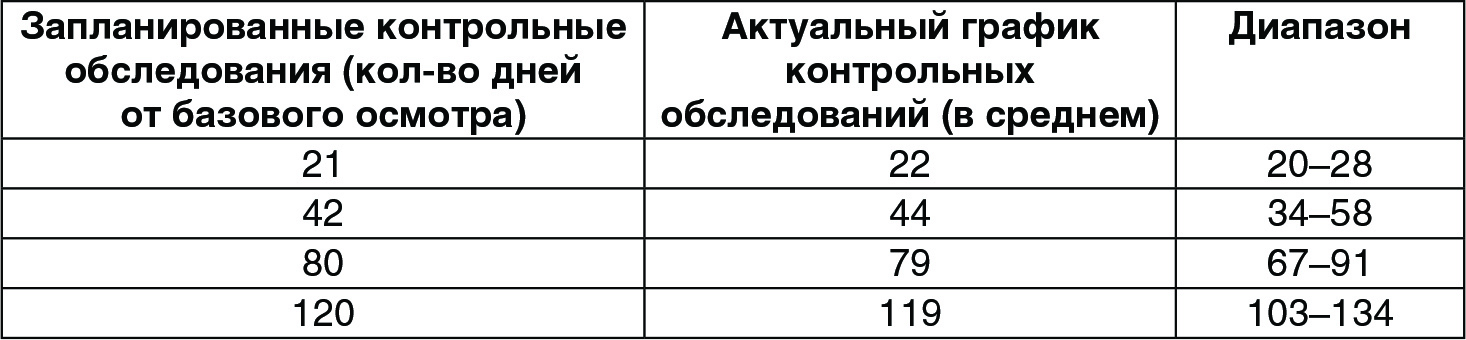
(Таблица 4) Контрольные обследования (запланированный и актуальный график).
Количество пациентов, показывающих высокие баллы по шкале БиглиГибсон, постепенно сокращалось, как показано на рис. 3, что свидетельствует о том, что эстетичный внешний вид пациентов улучшился. Наблюдалось значительное улучшение после третьего этапа инъекции (p = 0,017) и на последнем контрольном обследовании (p = 0,017) по сравнению с результатами на базовом этапе. Фотографии декольте подтвердили улучшение внешнего вида кожи (рис. 4A); дерматоскопическое обследование (рис. 4B) показало, что при последней инъекции (день 42) первичные линии имели одинаковую глубину и «звездообразную форму», соответствующие 1-му классу по шкале Бигли-Гибсона. Более того, эти характеристики также наблюдались во время контрольного обследования. Когда участники были классифицированы по результатам лечения, число пациентов в группе «прогресс» на 40-й, 80-й и 120-й день значительно увеличилось по сравнению с базовым уровнем (рис. 5, р < 0,05 во всех случаях).
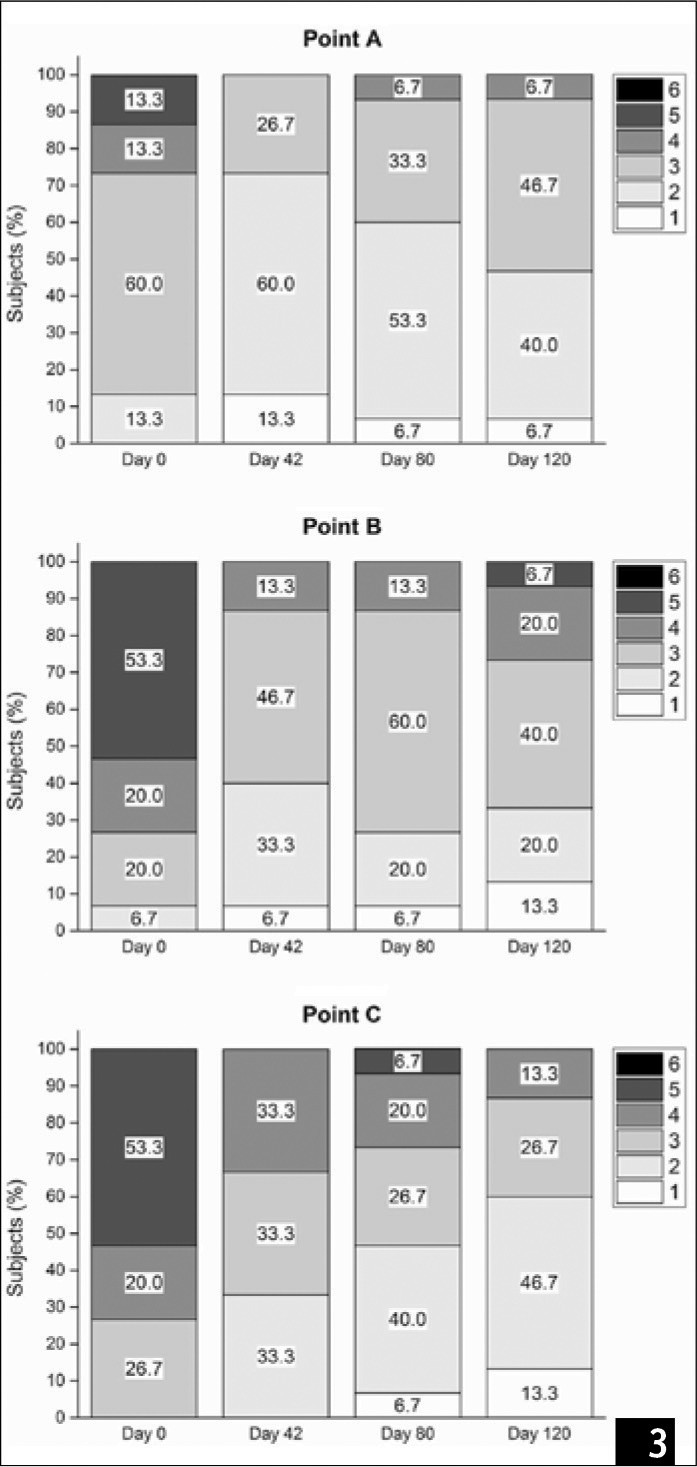
(Рис. 3) Распределение участников по шкале Бигли-Гибсона в различные временные отрезки наблюдения.
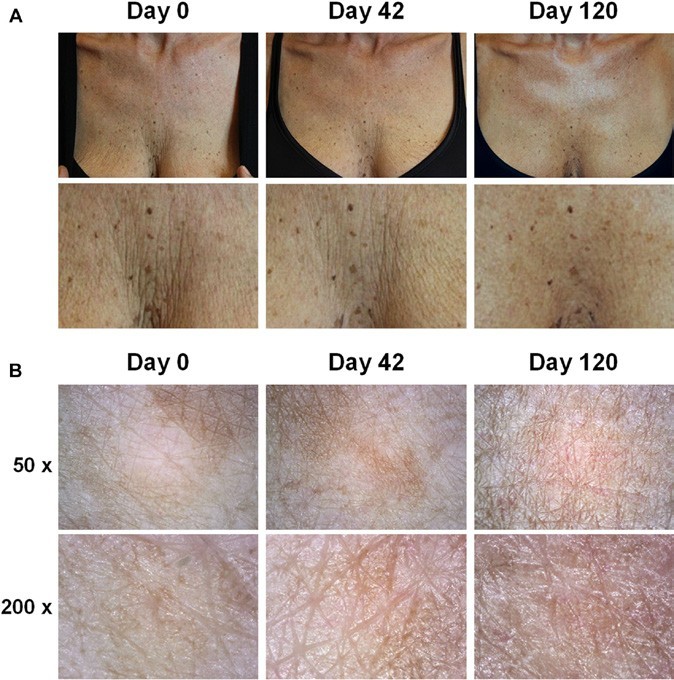
(Рис. 4) A. Пример пациента на базовом уровне (день 0); во время последней (третьей) инъекции (день 42); во время последнего контрольного обследования (день 120). Омолаживающий эффект после последней инъекции существенный и сохраняется с течением времени. На нижних снимках увеличены изображения области грудной клетки, показанные выше. На финальном контрольном обследовании препарат восстановил гидратацию и свел к минимуму проявления вялости кожи в области грудной клетки, заметно восстановил упругость и эластичность кожи
В. Внешний вид кожи при дерматоскопическом обследовании точки А в начале исследования, после 42-го и 120-го дней исследования. Результаты для точек B и C (не показаны) были схожи. При последней инъекции (день 42) первичные линии имеют ту же глубину и «звездообразную форму», соответствующую оценке 1 по шкале Бигли-Гибсона. Эти характеристики все еще можно было наблюдать на последнем контрольном обследовании.
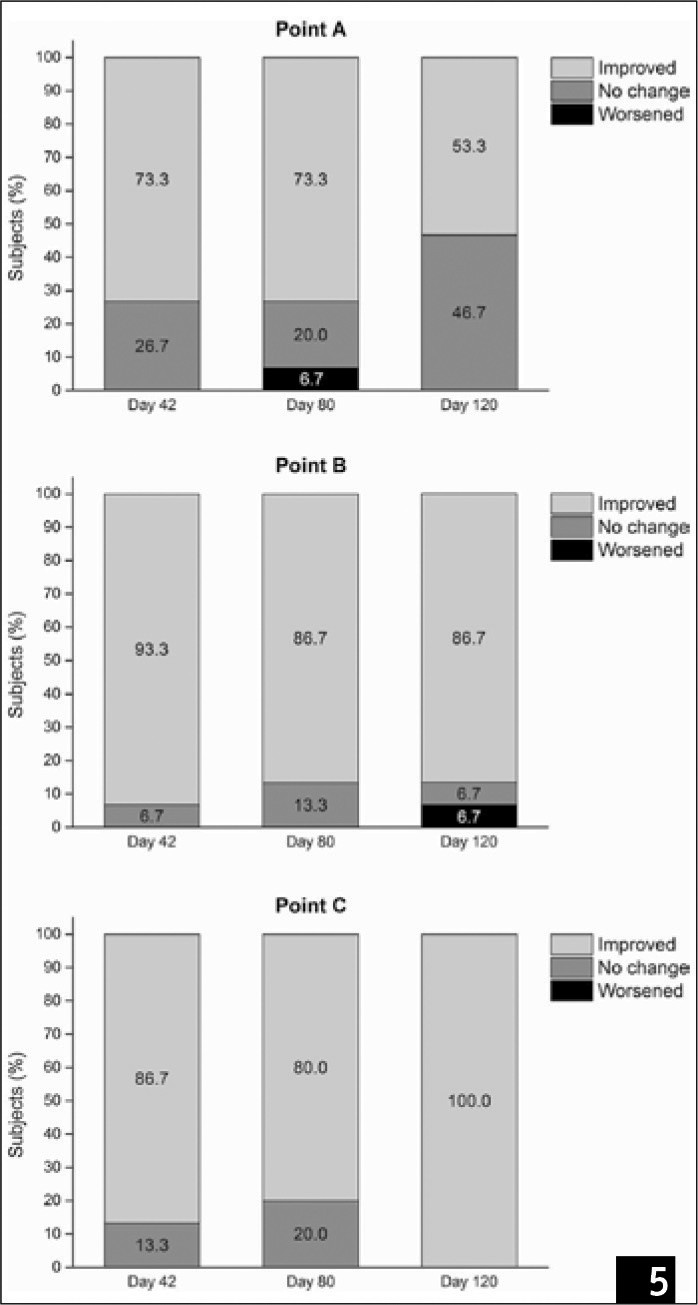
(Рис. 5) Распределение участников по группам «без изменений», «регресс», «прогресс» согласно баллам, набранным по шкале Бигли-Гибсона в разные временные отрезки в сравнении с базовым уровнем.
Показания при обследовании на 120-й день существенно не отличались от показаний обследования на 80-й день для всех точек измерения (точка A, p = 0,48, точка B, p = 0,74, точка C, p = 0,08), что показывает, что эффект лечения сохраняется с течением времени.
Результаты оценивания по шкале Фаби-Болтона показаны на рис. 6 и в Средний возраст участников соста вил 49,0 ± 8,0 (диапазон 30-65). Десять участников (66,7%) – курящие. Классификация пациентов согласно фототипу по Фитцпатрику, фотостарению по Рубину, по шкале Бигли-Гибсона и шкале Фаби-Болтона на исходном уровне приведена в таблице 3. Все контрольные обследования выполнялись четко по запланированному графику без нарушений (таблица 4). Во время каждого этапа лечения все пациенты получали инъекцию ГК по 2 мл.
Количество пациентов, показывающих высокие баллы по шкале БиглиГибсон, постепенно сокращалось, как показано на рис. 3, что свидетельствует о том, что эстетичный внешний вид пациентов улучшился. Наблюдалось значительное улучшение после третьего этапа инъекции (p = 0,017) и на последнем контрольном обследовании (p = 0,017) по сравнению с результатами на базовом этапе. Фотографии декольте подтвердили улучшение внешнего вида кожи (рис. 4A); дерматоскопическое обследование (рис. 4B) показало, что при последней инъекции (день 42) первичные линии имели одинаковую глубину и «звездообразную форму», соответствующие 1-му классу по шкале Бигли-Гибсона. Более того, эти характеристики также наблюдались во время контрольного обследования. Когда участники были классифицированы по результатам лечения, число пациентов в группе «прогресс» на 40-й, 80-й и 120-й день значительно увеличилось по сравнению с базовым уровнем (рис. 5, р < 0,05 во всех случаях) .
Показания при обследовании на 120й день существенно не отличались от потаблице 5. В то время как большинство участников на исходном этапе получили оценки 2 и 3, а 2 участника (13,3%) получили 4, то на контрольном обследовании (день 120-й) большинство пациентов набрали 1 и 2, и никто не получил оценку 4 (рис. 6). Изменение оценок по шкале Фаби-Болтона между двумя временными отрезками было значительным (p < 0,05) (таблица 5), что указывает на существенный прогресс участников с течением времени.
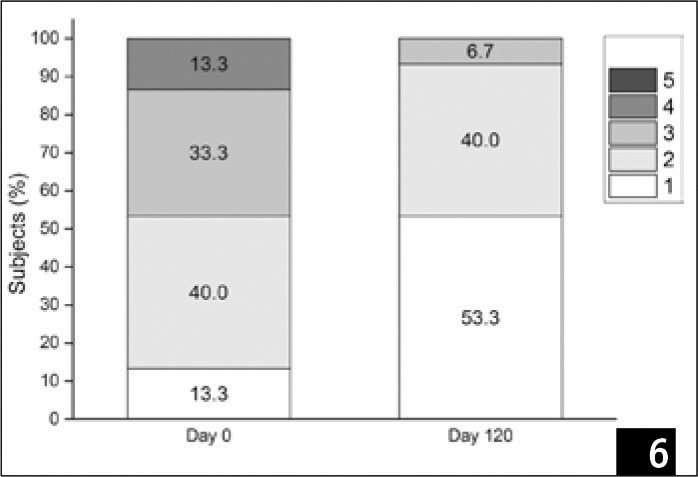
(Рис. 6) Распределение участников по набранным баллам по шкале Фаби-Болтона на базовом уровне и на 120-й день.
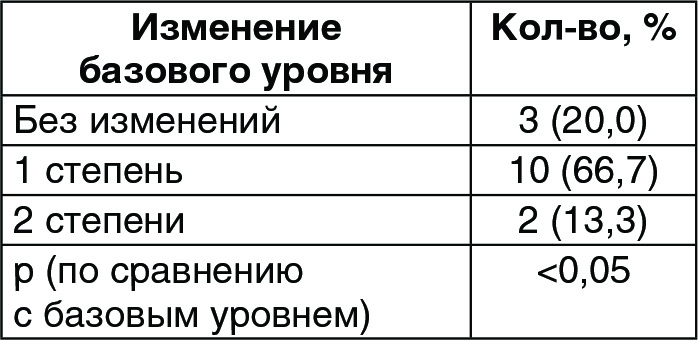
(Таблица 5) Распределение участников согласно изменениям по набранным баллам по шкале Фаби-Болтона на 120-й день по сравнению с базовым уровнем.
Субъективные оценки участников и исследователей относительно преимущества лечения в основном были удовлетворительными (≥ 6) на протяжении всего лечения и во время контрольных обследований (рис. 7). В целом, участники поставили более высокие бал лы, чем исследователи: самый низкий балл, который был поставлен участниками (два случая), составлял 7, в то время как самый низкий балл, поставленный исследователями, составлял 6 (четыре случая). На контрольном обследовании (120-й день наблюдения) пациенты и исследователи выставили субъективную оценку между 8 и 10 в 93,3% и 80% случаев соответственно (рис. 7).
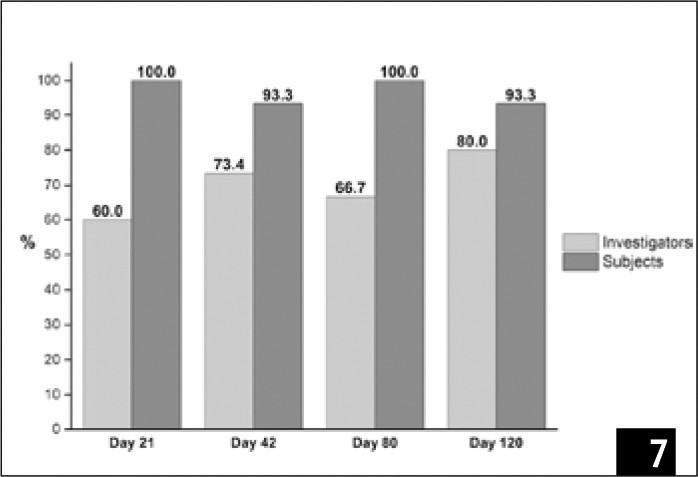
(Рис. 7) Процентное соотношение случаев, получивших оценку от 8 до 10 согласно субъективному восприятию результата (0 – нет результата; 10 – максимальный результат) двумя исследователями (светло-серым) и 15 участницами (темно-серым) на протяжении различных временных отрезков.
Что касается безопасности, то у 11 участников были обнаружены синяки (73,3%) и сохранялись в среднем 5,9 ± 1,0 дней. Покраснение наблюдалось у 8 участников (53,3%), средняя длительность 9,1 ± 6,9 часа. Один пациент (6,7%) жаловался на умеренные волдыри после первой инъекции. Все нежелательные реакции были определены и решены в разумный срок.
Обсуждение результатов
Результаты настоящего исследования показывают, что исследуемая рецептура ГК может обеспечить существенное постоянное и объективное сокращение морщин в области декольте в течение 120 дней после первой инъекции. Благодаря характеру и степени поперечной связи ГК-ACР, которой свойственно постепенное выделение с течением времени, оказывая увлажняющие и омолаживающие действия, а также благодаря природным свойствам увлажнения и вязкоупругости природного полимера, эластичность и упругость кожи повышается на длительный период [45]. Кроме того, повышение давления за счет регидратации ГК может привести к реактивации фибробластов и стимулированию производства коллагена. Было обнаружено, что локальный рост механических сил внутри дермы позволяет эффективно перепрограммировать фибробласты для повышения регуляции образования коллагена в коже человека во всем организме [11, 46]. В-третьих, когда ГК-ACР расщепляется, она также высвобождает исходные мономеры в 200 кДа, используемые для ее изготовления [30], что может стимулировать резкое увеличение количества кожных фибробластов и кератиноцитов [32]. По наблюдениям данного исследования все вышеперечисленные механизмы приводят к существенному восстановлению эластичности и упругости кожи.
ГК-ACР уже доказала свою безопасность и эффективность при лечении старения лица [34]. Результаты настоящего исследования показывают, что ГК-ACР также оказывает существенное омолаживающее действие, а также возвращает упругость кожи в зоне грудной клетки, которая в силу своих анатомических характеристик [1-4] является одной из самых сложных зон для лечебных омолаживающих процедур в целом и на основе инъекционных препаратов ГК [43].
Говоря об омолаживающем лечении, основополагающей целью врачей и пациентов является эффективное улучшение эстетического состояния. Что касается эстетической пользы от лечения ГК-ACР, то субъективные оценки пациентов и исследователей были очень высокие.
Более того, препарат ГК-ACР был тщательно разработан и его использование полностью безопасно. Побочные эффекты проявились в виде легких синяков и покраснений, что является нормальной реакцией после лечения с применением внутрикожных инъекций. Продолжительность данных проявлений была в пределах нормы для такого вида лечения [47], также не наблюдались какие-либо узловые формирования в местах ввода инъекции ни во время этого исследования, ни в других случаях, когда авторы использовали ГК-ACР в своей клинической практике. Отсутствие появления инородного тела или других серьезных реакций может быть связано с усиленными показателями безопасности ГК-ACР. Будучи автоматически (не химически) сшитой, она вызывает меньше раздражения, чувствительности или реакции инородного тела. Также грудная клетка не склонна к осложнениям, возникающим из-за закупорки сосудов, к которым склонно лицо [48]. ГК не является сшитой химически, что способствует непосредственному ее расщеплению. Это может дополнительно снизить вероятность проявления нежелательных побочных эффектов после инъекции. Однако гиалуронидаза всегда должна быть под рукой при введении внутрикожных инъекционных препаратов на основе ГК.
Пациенты, принимающие участие в настоящем исследовании, также сообщили, что не ощущали болевых симптомов, как во время инъекции, так и после нее. Никаких инфекций или серьезных побочных эффектов не было зарегистрировано, и ни один пациент не прекратил лечение из-за неблагоприятной реакции.
Недостатками данного исследования является небольшое количество пациентов и отсутствие контрольной группы, которая была бы обработана другими препаратами на основе ГК с более долгой историей использования для омоложения декольте. Как и в случае других методов омоложения, эффект биоревитализации, который может быть получен после ГК-ACР, не считается однозначным; тем не менее, пока еще не хватает длительного наблюдения касательно сохранения эффекта после применения ГК-ACР. Для подтверждения результатов данного проспективного экспериментального исследования в дальнейшем необходимо проведение проспективных исследований с участием большего количества пациентов и в течение более длительного периода наблюдения, а также с участием надлежащей контрольной группы.
Выводы
ГК-ACР – омолаживающий инъекционный медицинский препарат, исследуемый в данной статье, является безопасным, хорошо переносимым и обеспечивающим долговременное омолаживающее действие и эффективным средством для разглаживания морщин в области декольте. Для подтверждения данных результатов дальнейшие проспективные контрольные исследования лечения старения должны проводиться с участием большего количества пациентов и в сравнении с другими «сшитыми» препаратами на основе ГК.
Конфликт интересов. Авторы заявляют, что не имеют конфликтов интересов по разглашению информации.
Литература
- Peterson J. D., Goldman M. P. Rejuvenation of the aging chest: a review and our experience. Dermatol Surg. 2011; 37: p. 555-571.
- Peterson J. D., Kilmer S. L. Three Dimensional Rejuvenation of the Decolletage. Dermatol Surg. 2016; 42 (Suppl 2): p. S101-S107.
- Mazzuco R., Hexsel D. Poly-L-lactic acid for neck and chest rejuvenation. Dermatol Surg. 2009; 35: p. 1228-1237.
- Otberg N., Richter H., Schaefer H., Blume-Peytavi U., Sterry W., Lademann J. Variations of hair follicle size and distribution in different body sites. J. Invest Dermatol. 2004; 122 (1): p. 14-19.
- Hwang K., Kim J. Y., Lim J. H. Anatomy of the platysma muscle. J. Craniofac Surg. 2017; 28 (2): p. 539-542.
- Becker-Wegerich P. M., Rauch L., Ruzicka T. Botulinum toxin A: successful decollete rejuvenation. Dermatol Surg. 2002; 28 (2): p. 168-171.
- Wlaschek M., Tantcheva-Poor I., Naderi L., Ma W., Schneider L. A., Razi-Wolf Z., Schuller J., ScharffetterKochanek K. Solar uv irradiation and dermal photoaging. J. Photochem Photobiol. 2001; B 63: p. 41-51.
- Kammeyer A., Luiten R. M. Oxidation events and skin aging. Ageing Res Rev. 2015; 21: p. 16-29.
- Yaar M., Eller M. S., Gilchrest B. A. Fifty years of skin aging. J. Investig Dermatol Symp Proc. 2002; 7 (1): p. 51-58.
- Rittie L., Fisher G. J. Natural and suninduced aging of human skin. Cold Spring Harb Perspect Med. 2015; 5 (1): p. a015370.
- Quan T., Fisher G. J. Role of ageassociated alterations of the dermal extracellular matrix microenvironment in human skin aging: a mini-review. Gerontology. 2015; 61 (5): p. 427-434.
- Sherratt M. J. Age-related tissue stiffening: cause and effect. Adv Wound Care (New Rochelle). 2013; 2 (1): p. 11-17.
- Kurban R. S., Bhawan J. Histologic changes in skin associated with aging.
- Dermatol Surg Oncol. 1990 16 (10): p. 908-914.
- El-Domyati M., Attia S., Saleh F., Brown D., Birk D. E., Gasparro F., Ahmad H., Uitto J. Intrinsic aging vs. photoaging: a comparative histopathological, immunohistochemical, and ultrastructural study of skin. Exp Dermatol. 2002; 11 (5): p. 398-405
- Gniadecka M., Nielsen O. F., Wessel S., Heidenheim M., Christensen D. H., Wulf
- C. Water and protein structure in photoaged and chronically aged skin. J. Invest Dermatol. 1998; 111 (6): p. 1129-1133.
- Lee D. H., Oh J. H., Chung J. H. Glycosaminoglycan and proteoglycan in skin aging. J. Dermatol Sci. 2016; 83 (3): p. 174-181.
- Oh J. H., Kim Y. K., Jung J. Y., Shin
- E., Kim K. H., Cho K. H., Eun H. C., Chung J. H. Intrinsic agingand photoaging-dependent level changes of glycosaminoglycans and their correlation with water content in human skin. J. Dermatol Sci. 2011; 62 (3): p. 192-201.
- Tzellos T. G., Klagas I., Vahtsevanos K., Triaridis S., Printza A., Kyrgidis A., Karakiulakis G., Zouboulis C. C., Papakonstantinou E. Extrinsic ageing in the human skin is associated with alterations in the expression of hyaluronic acid and its metabolizing enzymes. Exp Dermatol. 2009; 18 (12): p. 1028-1035.
- Fraser J. R., Laurent T. C., Laurent
- B. Hyaluronan: its nature, distribution, functions and turnover. J. Int Med. 1997; 242 (1): p. 27-33.
- Cowman M. K., Matsuoka S. Experimental approaches to hyaluronan structure. Carbohydr Res. 2005; 340 (5): p. 791-809.
- Dea I. C., Moorhouse R., Rees
- A., Arnott S., Guss J. M., Balazs E. A. Hyaluronic acid: a novel, double helical molecule. Science. 1973; 179 (4073): p. 560-562.
- Tezel A., Fredrickson G. H. The science of hyaluronic acid dermal fillers.
- Cosmet Laser Ther. 2008; 10 (1): p. 35-42. Erratum in: J. Cosmet Laser Ther. 2014; 16 (1): p. 45.
- Matarasso S. L. Understanding and using hyaluronic acid. Aesthet Surg J. 2004; 24 (4): p. 361-364.
- Collins M. N., Birkinshaw C. Physical properties of crosslinked hyaluronic acid hydrogels. J. Mater Sci Mater Med. 2008; 19 (11): p. 3335-3343.
- Highley C. B., Prestwich G. D., Burdick J. A. Recent advances in hyaluronic acid hydrogels for biomedical applications. Curr Opin Biotechnol. 2016; 40: p. 35-40.
- Beasley K. L., Weiss M. A., Weiss R. A. Hyaluronic acid fillers: a comprehensive review. Facial Plast Surg. 2009; 25 (2): p. 86-94.
- Greene J. J., Sidle D. M. The hyaluronic acid fillers: current understanding of the tissue device interface. Facial Plast Surg Clin North Am. 2015; 23 (4): p. 423-432.
- Sparavigna A., Fino P., Tenconi B., Giordan N., Amorosi V., Scuderi N. A new dermal filler made of cross-linked and auto-cross-linked hyaluronic acid in the correction of facial aging defects. J. Cosmet Dermatol. 2014; 13 (4): p. 307-314.
- Alessandrini A., Fino P., Giordan N., Amorosi V., Scuderi N. Evaluation of a new hyaluronic acid dermal filler for volume restoration. J. Cosmet Laser Ther . 2015; 17 (6): p. 335-342.
- Pluda S., Pavan M., Galesso D., Guarise C. Hyaluronic acid auto-crosslinked polymer (ACP): reaction monitoring, process investigation and hyaluronidase stability. Carbohydr Res. 2016; 433: p. 47-53.
- Renier D., Bellato P., Bellini D., Pavesio A., Pressato D., Borrione A. Pharmacokinetic behaviour of ACP gel, an autocrosslinked hyaluronan derivative, after intraperitoneal administration. Biomaterials. 2005; 26 (26): p. 5368-5374.
- Wohlrab J., Wohlrab D., Neubert R. H. Comparison of noncrosslinked and cross-linked hyaluronic acid with regard to efficacy of the proliferative activity of cutaneous fibroblasts and keratinocytes in vitro. J. Cosmet Dermatol. 2013; 12 (1): p. 36-40.
- Alessandrini A., Di Bartolo C., Pavesio A., Pressato D. ACP gel: a new hyaluronic acid-based injectable for facial rejuvenation. Preclinical data in a rabbit model. Plast Reconstr Surg. 2006 ; 118 (2): p. 341-346.
- Di Pietro A., Colomba D. M., Giordan N. Facial wrinkles correction and skin rejuvenation (biostimulation) by auto-crosslinked hyaluronic acid. J. Plast Dermatol. 2007; 3: p. 2-5.
- Holman C. D., Armstrong B. K., Evans P. R., Lumsden G. J., Dallimore K. J., Meehan C. J., Beagley J., Gibson I. M. Relationship of solar keratosis and history of skin cancer to objective measures of actinic skin damage. Br J. Dermatol. 1984; 110 (2): p. 129-138.
- Fitzpatrick T. B. The validity and practicality of sun-reactive skin types I through VI. Arch Dermatol. 1988; 124 (6): p. 869-871.
- Rubin M. Manual of chemical peels: superficial and medium depth. Lippincott & Williams, Philadelphia. 1995.
- Fabi S., Bolton J., Goldman M. P., Guiha I. The Fabi-Bolton chest wrinkle scale: a pilot validation study. J. Cosmet Dermatol. 2012; 11 (3): p. 229-234.
- Russo T., Piccolo V., Lallas A., Argenziano G. Recent advances in dermoscopy. F1000Res. 2016; 5. pii: F1000 Faculty Rev 184
- Lallas A., Giacomel J., Argenziano G., Garca-Garca B., Gonzalez-Fernandez D., Zalaudek I., Vazquez-Lopez F. Dermoscopy in general dermatology: practical tips for the clinician. Br J. Dermatol. 2014; 170 (3): p. 514-526.
- Choi Y. H., Kim D., Hwang E., Kim B. J. Skin texture aging trend analysis using dermoscopy images. Skin Res Technol. 2014; 20 (4): p. 486-497.
- Isik B., Gurel M. S., Erdemir A. T., Kesmezacar O. Development of skin aging scale by using dermoscopy. Skin Res Technol. 2013; 19 (2): p. 69-74.
- Vanaman M., Fabi S. G. Decolletage: regional approaches with injectable fillers. Plast Reconstr Surg. 2015; 136 (5 Suppl): p. 276S-281S.
- Kerscher M., Bayrhammer J., Reuther T. Rejuvenating influence of a stabilized hyaluronic acid-based gel of nonanimal origin on facial skin aging. Dermatol Surg. 2008; 34 (5): p. 720-726.
- Kablik J., Monheit G. D., Yu L., Chang G., Gershkovich J. Comparative physical properties of hyaluronic acid dermal fillers. Dermatol Surg. 2009; 35 (Suppl 1): p. 302-312.
- Wang F., Garza L. A., Kang S., Varani J., Orringer J. S., Fisher G. J., Voorhees J. J. In vivo stimulation of de novo collagen production caused by cross-linked hyaluronic acid dermal filler injections in photodamaged human skin. Arch Dermatol. 2007; 143 (2): p. 155-163.
- Chiang Y. Z., Pierone G., AlNiaimi F. Dermal fillers: pathophysiology, prevention and treatment of complications. J. Eur Acad Dermatol Venereol. 2017; 31 (3): p. 405-413.
- Salval A., Ciancio F., Margara A., Bonomi S. Impending facial skin necrosis and ocular involvement after dermal filler injection: a case report. Aesthetic Plast Surg. 2017 May 31. [Epub ahead of print].
